Can Thiệp Phình Động Mạch Chủ

Khám phá về phình mạch
Galen được ghi nhận là người đầu tiên định nghĩa và mô tả chứng phình động mạch, chủ yếu là những phình động mạch có thể nhìn thấy và sờ thấy trên bề mặt cơ thể, trong khi chứng phình động mạch sâu thì phổ biến hơn.
Vào thế kỷ thứ 2, Antyllos phát hiện ra sự khác biệt giữa phình mạch giả và thật.
Aetius, vào thế kỷ thứ 6, đã mô tả các triệu chứng lâm sàng của chứng phình mạch và phát hiện chúng có thể xảy ra ở bất cứ đâu trên cơ thể, thậm chí cả ở đầu.
Phình động mạch chủ (AA) được Saporta mô tả lần đầu tiên vào năm 1554 và được Vesalius chẩn đoán lần đầu vào năm sau đó.
Từ thế kỷ 17 đến thế kỷ 18, nhiều học giả đã khảo sát các đặc điểm bệnh lý và nguyên nhân hình thành chứng phình mạch:
(1)Sennertus (1628) tin rằng chính sự đứt gãy của lớp trong đã dẫn đến sự giãn nở của lớp ngoài;
(2)Iseman (1676) bác bỏ ý kiến này, cho rằng chứng phình động mạch được hình thành chủ yếu do vỡ thành động mạch chủ khiến máu khuếch tán đến các mô thoát mạch.
(3)Bourdelot (1681) phát hiện chứng phình mạch không do chấn thương tuy chứng phình mạch do chấn thương bên ngoài vẫn thường gặp nhất.
(4)Lancisi (1728) là người đầu tiên ghi nhận dị dạng mạch máu bẩm sinh có thể là nguyên nhân gây giãn mạch dưới áp lực.
(5)Alexander Monro (1733) đã mô tả sự khác biệt giữa chứng phình mạch thật và giả nhưng lầm tưởng rằng phình mạch thật rất hiếm và không nhận thấy mô đàn hồi được thay thế bằng mô sợi trong giai đoạn đầu của phình mạch.
(6)Home và John Hunter tin rằng bệnh động mạch từ trước là nguyên nhân gây ra phình mạch.
(7)Donald Monro (1760) , qua một phẫu tích đại thể, cho thấy phình mạch không phải do vỡ lớp áo trong và giãn nở của lớp áo ngoài mà do sự giãn nở của tất cả các lớp.
Vào thế kỷ 19, nhờ sự ra đời của máy cắt vi mô (microtome), kính hiển vi cũng như nhà nghiên cứu bệnh học, thế giới đã hiểu biết sâu sắc hơn về cơ chế bệnh lý của chứng phình mạch.
(1)Welch (1875) đã phân lập được giang mai từ mô phình mạch nên cho rằng bệnh giang mai là một nguyên nhân, bổ sung vào nhóm nguyên nhân gây phình mạch.
(2)Coats và Auld (1893) đã phát hiện phình mạch sớm là do máu đi qua các vết loét của mãng xơ vữa, và các sợi đàn hồi được phát hiện bị đứt đột ngột hoặc biến mất dần dần bằng phương pháp nhuộm màu.
Cho đến thế kỷ 20, xơ vữa động mạch và giang mai được công nhận là hai nguyên nhân quan trọng nhất gây phình mạch.
Trong 30 năm qua, đã có những tiến bộ đáng kể trong nghiên cứu cơ chế bệnh sinh của chứng phình mạch.
Trong suốt cuộc đời của một người khỏe mạnh, các thành phần hoạt động của thành động mạch chủ phải được tái tạo liên tục để duy trì tính toàn vẹn và chức năng cũng như chịu được áp lực lặp đi lặp lại của thành động mạch. Thật không may, hệ thống này trở nên mất ổn định do bệnh tật hoặc các quá trình phức tạp khác, và một phần của thành động mạch chủ có thể bị suy yếu và phình lên vĩnh viễn, hình thành chứng phình mạch, chủ yếu ở động mạch chủ ngực, bụng và động mạch nội sọ bao quanh đa giác Willis.
Phình mạch vỡ khi thành mạch không chịu được áp lực do dòng máu chảy bên trong tạo ra, dẫn đến tử vong đột ngột hoặc tàn tật nặng. Nguyên nhân chính xác của bệnh vẫn chưa được biết, nhưng một giả thuyết phổ biến là những thay đổi của lực huyết động tác động lên thành mạch là yếu tố chính góp phần vào nguồn gốc và sự tiến triển của bệnh.
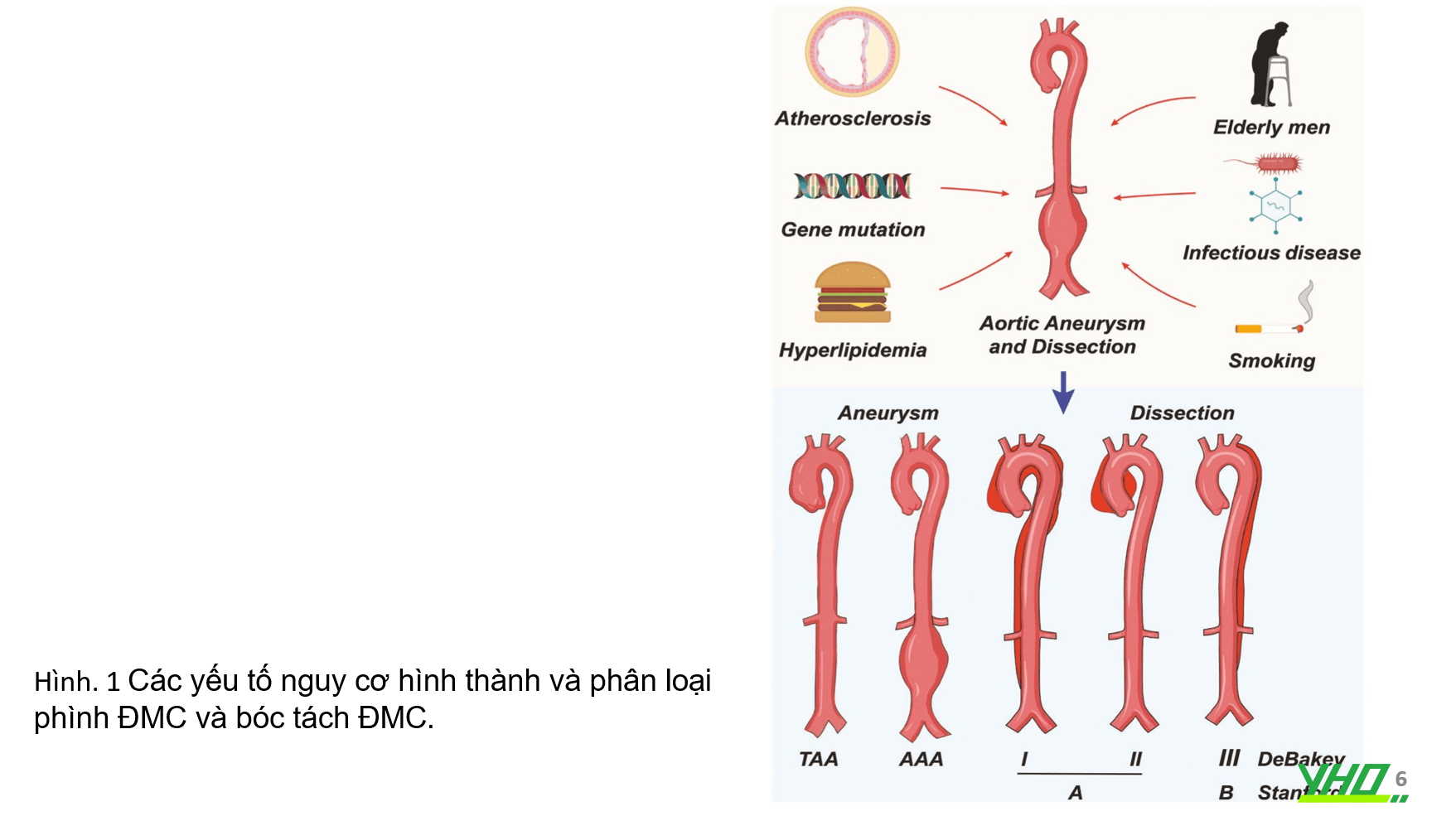
Phân loại
Phình ĐMC (AA) thường được phân loại thành phình ĐMC bụng (AAA), phình ĐMC ngực (TAA), phình động mạch nội sọ, v.v. Vì các tế bào cơ trơn ở ĐMC ngực có nguồn gốc từ mào thần kinh và trung bì cơ thể, trong khi các tế bào cơ trơn ở ĐMC bụng có nguồn gốc từ trung bì nội tạng, cơ chế bệnh sinh của TAA so với AAA khác nhau.
Bóc tách ĐMC (AD), là do vỡ lớp áo trong đến lớp giữa. Phân loại AD và AA chủ yếu dựa trên vị trí giải phẫu. AD có nhiều khả năng xảy ra ở động mạch chủ xuống do các phần của mạch máu được biệt hóa với các tế bào thuộc các lớp khác nhau trong quá trình phát triển phôi thai.
Theo De Bakey, bóc tách ĐMC được chia thành ba týp.
- 1.Týp I: kéo dài từ động mạch chủ lên đến động mạch chủ bụng.
- 2.Týp II: bóc tách giới hạn ở động mạch chủ lên,
- 3.Týp III:
- -Týp IIIa: tổn thương từ động mạch dưới đòn trái đến trên cơ hoành.
- -Týp IIIb: tổn thương từ động mạch chủ xuống đến ĐMC bụng và ĐM chậu.
Phân loại Stanford chia bóc tách ĐMC thành hai týp:
- 1.Týp A: bóc tách từ ĐMC lên;
- 2..Týp B: bóc tách từ sau ĐM dưới đòn trái, kéo dài đến ĐMC xuống (Hình 1).
Nguyên nhân
Hầu hết các AAA đều không có nguyên nhân rõ ràng. Một số ít có nguyên nhân như xơ vữa động mạch, chấn thương, bệnh mô liên kết (Hội chứng Marfan, Ehlers‒Danlos týp IV), bệnh truyền nhiễm (lao, giang mai, vi khuẩn, nấm) và các bệnh viêm nhiễm.
Bệnh xơ vữa động mạch và AA có các yếu tố nguy cơ tương tự nhau và tổn thương xơ vữa động mạch được coi là nguyên nhân của một số phình mạch. Dwayne Reed đã tiến hành theo dõi hơn 8000 người đàn ông Nhật Bản ở Hawaii trong 20 năm, tích lũy dữ liệu lâm sàng và khám nghiệm tử thi, đồng thời phân tích nguyên nhân gây ra chứng xơ vữa động mạch trong sự phát triển của AA. Từ góc độ phòng ngừa, các yếu tố nguy cơ gây xơ vữa ĐMC và bản thân chứng XVĐM có quan hệ nhân quả đối với đại đa số các AA trong đoàn hệ này.
Các bệnh mô liên kết, bao gồm Hội chứng Marfan và Ehlers‒Danlos týp IV, hầu hết đều liên quan đến AA. Hội chứng Marfan là một rối loạn mô liên kết có hệ thống gây ra bởi đột biến ở protein chất nền ngoại bào fibrillin 1. Các biểu hiện lâm sàng chính bao gồm AA ở đầu gần, trật khớp thuỷ tinh thể và phát triển quá mức các xương dài. Fibrillin 1 là thành phần chính của vi sợi chất nền ngoại bào. Ở những bệnh nhân mắc hội chứng Marfan, động mạch chủ có biểu hiện giảm hàm lượng elastin và đứt các sợi đàn hồi, dẫn đến phình hoặc bóc tách động mạch chủ.
Có nhiều yếu tố nguy cơ đối với AA, bao gồm thói quen sinh hoạt xấu và các bệnh mạn tính khác như hút thuốc, tuổi tác, THA, COPD, tăng lipid máu và các yếu tố di truyền như giới tính nam, chủng tộc da trắng và tiền sử gia đình.
Đàn ông lớn tuổi có nhiều khả năng mắc AA hơn. Tử vong do vỡ AA bắt đầu tăng đáng kể ở những người trên 65 tuổi. Tỷ lệ mắc AAA ở nam cao gấp sáu lần so với nữ, với nguy cơ tăng 40% mỗi 5 năm sau 65 tuổi. Các nghiên cứu cũng phát hiện ra rằng người da đen, người gốc Tây Ban Nha và Người châu Á có nguy cơ mắc AA thấp hơn người da trắng và người Mỹ bản địa.
Có mối tương quan lâm sàng chặt chẽ giữa hút thuốc và sự xuất hiện, phát triển của AA. Wilmink phát hiện những người hút thuốc có nguy cơ bị phình mạch cao gấp 7,6 lần so với những người không hút thuốc và những người từng hút thuốc có nguy cơ mắc phình mạch cao gấp 3 lần so với những người không hút thuốc. Thời gian hút thuốc có mối tương quan đáng kể với nguy cơ bị phình mạch.
Trong tất cả các quần thể, hút thuốc làm tăng nguy cơ vỡ AAA hàng năm 4% (95% CI 2%). Cơ chế sinh lý bệnh của việc hút thuốc ảnh hưởng đến sự xuất hiện và phát triển của AA vẫn chưa rõ ràng.
THA thường được coi là một yếu tố nguy cơ đối với AA, và huyết áp trung bình tăng cao là yếu tố nguy cơ độc lập dẫn đến vỡ phình mạch.
Tăng lipid máu là yếu tố nguy cơ đối với AA, trong khi HDL cao là yếu tố bảo vệ. Iribarren nhận thấy mức tăng cholesterol huyết thanh (>240 mg/dl) liên quan đến tỷ lệ chênh (OR) là 2,82 đối với AAA (KTC 95% 2,13–3,72). Pleumeeker đã báo cáo tác dụng bảo vệ của tăng HDL đối với AA.
Jonathan Golermer nhận thấy rằng bệnh tiểu đường có mối tương quan nghịch với chứng phình động mạch. Thời gian mắc bệnh tiểu đường càng dài mối liên hệ nghịch đảo càng rõ. Cơ chế có thể là bệnh đái tháo đường làm thay đổi quá trình sản xuất, thoái hóa và lắng đọng các glycosaminoglycan trong thành ĐMC.
Các yếu tố di truyền và gen gây bệnh vẫn đang được khám phá để thiết lập hồ sơ gen gây bệnh qua đó sàng lọc và phòng ngừa AA ở những quần thể có nguy cơ cao (Hình 1).
BIỂU HIỆN LÂM SÀNG: Triệu chứng
Phình mạch chưa vỡ thường không có triệu chứng và hầu hết được phát hiện khi khám thực thể ở những BN bệnh mạch vành, mạch ngoại biên hoặc mạch máu não.
AAA chưa vỡ có thể có các biến chứng như tắc mạch ngoại biên và rất hiếm gặp là huyết khối cấp tính. Ngoài ra còn có các biến chứng do túi phình đè lên các cấu trúc lân cận bao gồm đau thắt lưng, thận ứ nước khi cột sống hoặc niệu quản bị đè.
Vỡ AAA là tình trạng cấp cứu với biểu hiện đau bụng, ngực, lưng dữ dội kèm theo sốc với khối mạch đập ở bụng. Đây là bộ ba điển hình của vỡ AAA, nhưng chỉ 25– 50% BN có bộ ba điển hình này.
Vỡ thành trước bên vào khoang phúc mạc thường gây tử vong. Khi thành sau bị vỡ vào khoang sau phúc mạc, vết rách nhỏ ban đầu có thể được tạm thời bịt kín và khả năng chảy máu sẽ ít hơn. Tuy nhiên, trong vòng vài giờ, vết nứt sẽ lớn hơn. Sự phát triển hai giai đoạn này nhấn mạnh tầm quan trọng của giai đoạn trung gian sau sự kiện ban đầu.
Chẩn đoán phân biệt với nhồi máu cơ tim cấp tính, sỏi thận và các bệnh về đường tiêu hóa như thủng loét là cần thiết.
Hầu hết BN nhập viện cấp cứu đều phàn nàn về đau bụng, ngực và lưng. Cần kiểm tra siêu âm hoặc chụp cắt lớp vi tính (CT) để chẩn đoán.
- Siêu âm bụng định kỳ là tiêu chuẩn vàng để chẩn đoán và theo dõi AAA ở bệnh nhân không có triệu chứng, với độ chính xác gần 100%.
- CT là xét nghiệm hình ảnh tiêu chuẩn cho AAA vì có thể phát hiện phình mạch phức tạp, ảnh hưởng tới các mạch máu khác. CT cung cấp cơ sở cho việc lập kế hoạch can thiệp phẫu thuật. CT cũng có thể được thực hiện với hình ảnh 3D và chụp mạch, cung cấp thêm chi tiết giải phẫu. Chỉ định CT là cần thiết sau khi phát hiện AAA để xác định thêm các biện pháp can thiệp điều trị tiếp theo.
- Chụp cộng hưởng từ (MRI) cho phép quan sát một số cấu trúc lân cận phình mạch. MRI kết hợp với MRA cho phép quan sát các mạch máu khác. MRA sử dụng chất cản từ không độc cho thận (chẳng hạn như gadolinium). MRA ít gây hại hơn so với chụp mạch cản quang
- Chụp cắt lớp phát xạ Positron (PET), một phương pháp chụp ảnh chuyển hóa và phân tử, sử dụng fluorodeoxy-glucose F18 (18F-FDG) làm chất đánh dấu để xác định các khu vực tăng phân giải đường, chẳng hạn như một số vị trí viêm và khối u. Sự hấp thu 18F-FDG trong AAA có liên quan đến tình trạng viêm và thâm nhiễm thực bào, hoạt động phân giải protein của MMP và sự truyền tín hiệu tế bào và phân tử trước khi vỡ. Tuy nhiên, 18F-FDG không đặc hiệu trong hấp thu của AAA và hình ảnh AAA với PET vẫn còn là một thách thức.
- Chụp cắt lớp phát xạ Positron (PET), một phương pháp chụp ảnh chuyển hóa và phân tử, sử dụng fluorodeoxy-glucose F18 (18F-FDG) làm chất đánh dấu để xác định các khu vực tăng phân giải đường, chẳng hạn như một số vị trí viêm và khối u.38 Nhiều nghiên cứu đã chỉ ra rằng sự hấp thu 18F-FDG trong AAA có liên quan đến tình trạng viêm và thâm nhiễm thực bào , hoạt động phân giải protein của MMP và sự truyền tín hiệu tế bào và phân tử trước khi vỡ. Tuy nhiên, 18F-FDG không đặc hiệu trong hấp thu của AAA và hình ảnh AAA với PET vẫn còn là một thách thức.
Can thiệp nội mạch trong phình ĐMC bụng EndoVascular Aneurysm Repair for AAA
TỔNG QUAN
Phình động mạch chủ bụng (AAA) dưới thận thường gặp nhất.
Định nghĩa AAA là đường kính ĐMC > 3 cm hoặc từ gấp 1,5 – 2,0 lần đường kính ĐMC lân cận bình thường.
Do nguy cơ vỡ phình cao, việc sửa chữa được xem xét đối với AAA có D > 5,5 cm.
- ✓Theo truyền thống, phẫu thuật được coi là phương pháp điều trị tiêu chuẩn cho AAA. Tuy nhiên, sửa chữa phình mạch nội mạch (EVAR) bằng stent graft hiện đã nhanh chóng được mở rộng như một phương pháp điều trị chính cho AAA kể từ báo cáo đầu tiên của Parodi gần 30 năm trước.
- ✓Một nghiên cứu quan sát hồi cứu đối với những bệnh nhân đã trải qua EVAR đã cho thấy việc giảm tỷ lệ vỡ AAA và tỷ lệ tử vong ngắn hạn liên quan đến việc áp dụng và mở rộng chỉ định EVAR.
YẾU TỐ NGUY CƠ
Tuổi là yếu tố nguy cơ mạnh nhất đối với AAA.
Nguy cơ gia tăng cũng được ghi nhận với :
- ►Hút thuốc ,
- ►Giới tính nam,
- ►Mức huyết áp cao,
- ►Bệnh động mạch ngoại biên , bệnh động mạch cảnh,
- ►Tiền sử gia đình mắc bệnh AAA
SINH LÝ BỆNH
Theo truyền thống, XVĐM được coi là bệnh lý cơ bản chính cho sự phát triển của AAA. Tuy nhiên, các nghiên cứu hiện tại cho thấy vai trò của các yếu tố như di truyền, môi trường, huyết động và miễn dịch .
Ở cấp độ mô học, tình trạng viêm, quá trình chết theo chương trình của tế bào cơ trơn mạch máu, sự thoái hóa chất nền ngoại bào và stress oxy hóa có liên quan đến sự phát triển và tiến triển của AAA . Hơn nữa, tự miễn dịch cũng có thể đóng một vai trò trong sự phát triển và tiến triển của AAA .
Phình ĐMC có thể phát triển ở cả ĐMC ngực và ĐMC bụng. AAA phát triển dọc theo động mạch chủ bụng dưới thận, phổ biến hơn TAA với tỷ lệ mắc cao hơn ít nhất 9 lần . Sự khác biệt về cấu trúc thành mạch giữa động mạch chủ ngực và động mạch chủ bụng có thể là nguyên nhân gây ra tỷ lệ mắc AAA cao hơn TAA .
QUYẾT ĐỊNH ĐIỀU TRỊ
Quyết định điều trị AAA dựa trên biểu hiện lâm sàng và tình trạng phình ĐMC của bệnh nhân.
Theo hướng dẫn thực hành phẫu thuật mạch máu của Hiệp hội phẫu thuật mạch máu SVS, điều trị giải phẫu như phẫu thuật hoặc EVAR được chỉ định với mức khuyến nghị mạnh mẽ trong trường hợp : AAA vỡ, AAA không vỡ có triệu chứng và AAA lớn có đường kính > 5,5 cm (Bảng 1).
Nếu kích thước phình mạch nhỏ và BN không có triệu chứng liên quan đến AAA, điều trị giải phẫu sớm không mang lại lợi ích đáng kể về kỳ vọng sống.
CÂN NHẮC GIẢI PHẪU PHÙ HỢP EVAR
Sự phù hợp về mặt giải phẫu là yếu tố then chốt để thủ thuật EVAR thành công.
Khi được thực hiện ở những BN có giải phẫu phù hợp, EVAR hiệu quả trong việc ngăn ngừa tử vong liên quan đến khối phình.
Cổ túi phình động mạch chủ, hình thái phình và giải phẫu ĐM chậu nên được xem xét để EVAR thành công.
CỔ TÚI PHÌNH
Giải phẫu cổ túi phình ảnh hưởng lớn đến việc đưa, thả, và độ bền của stent graft vì cổ là vị trí cố định stent ở đoạn gần nhất và là yếu tố quan trọng nhất quyết định sự thành công của EVAR.
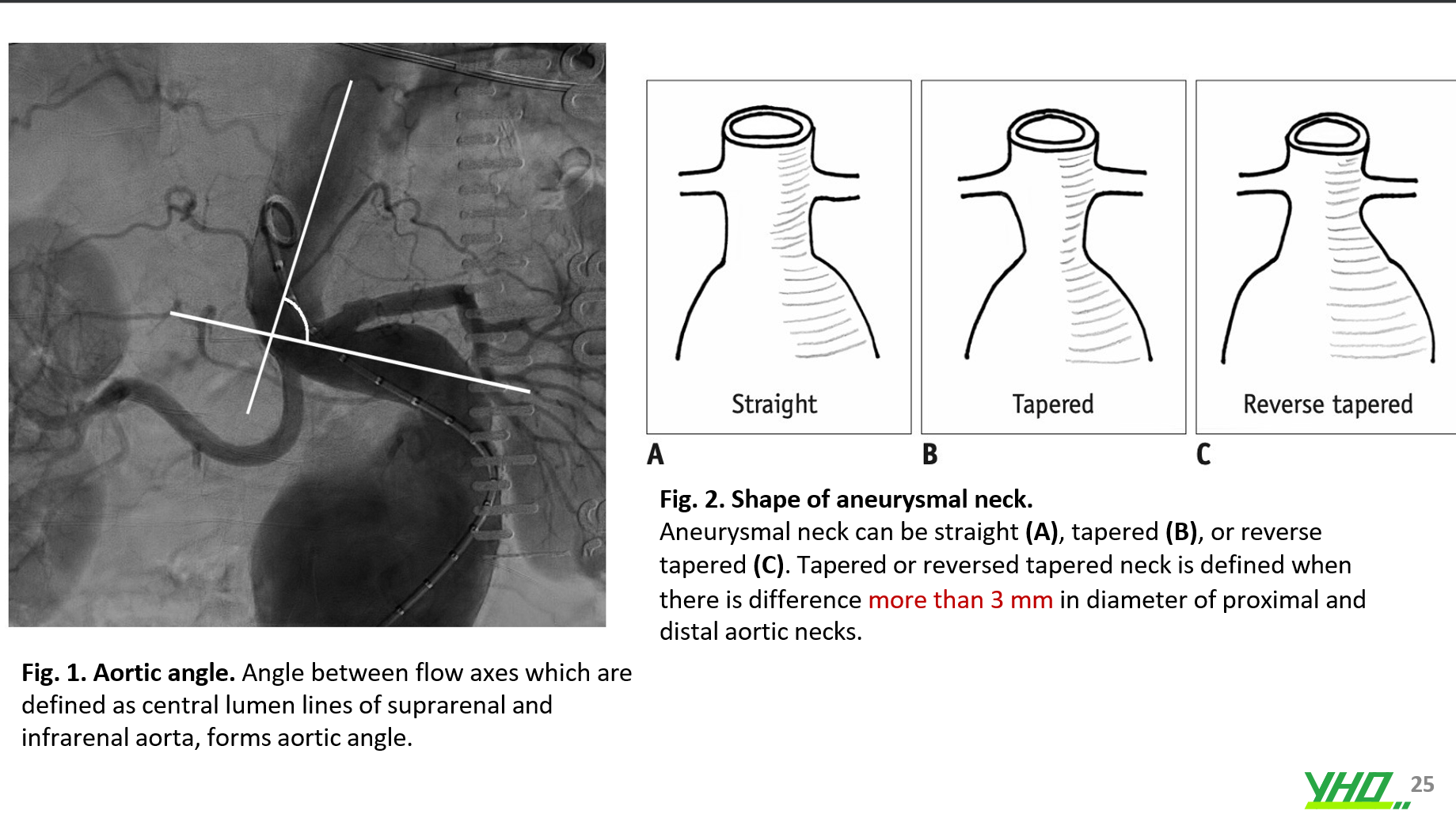
Chiều dài, góc, sự hiện diện của vôi hóa hoặc huyết khối, đường kính và hình dạng của cổ ĐMC nên được xem xét cẩn thận. Chiều dài cổ ĐMC được định nghĩa là khoảng cách từ động mạch thận thấp nhất đến đỉnh túi phình. Góc ĐMC được định nghĩa là góc giữa trục dòng chảy của ĐMC trên thận và ĐMCdưới thận (cổ túi phình động mạch) (Hình 1).
cổ ĐMC dài > 1,5 cm, góc ĐMC > 150° và cổ ĐMC không bị vôi hóa hoặc huyết khối được coi là thuận lợi cho EVAR.
cổ ĐMC ngắn < 1,0 cm, góc ĐMC < 120°, cổ ĐMC bị vôi hóa, có huyết khối > 50% chu vi được coi là bất lợi và không được chỉ định EVAR.
Hình dạng của cổ túi phình, xác định bởi sự khác biệt về đường kính giữa đầu gần và đầu xa, cũng có tầm quan trọng lớn. Hình dạng có thể thẳng, thon gọn hoặc thon gọn ngược (Hình 2). Thông thường, cổ thon gọn ngược với đường kính cổ ở phần xa lớn hơn phần gần thường cho kết quả phức tạp và cần theo dõi hình ảnh tỉ mỉ hơn sau EVAR
HÌNH THÁI KHỐI PHÌNH ĐMC
Giải phẫu phình ĐMC đề cập đến góc phình, sự hiện diện của huyết khối trong lòng mạch và các nhánh mạch từ phình mạch. Góc phình mạch là góc nhọn nhất trên đường đi qua lòng trung tâm giữa ĐM thận thấp nhất và chỗ chia đôi ĐMC. Nói chung, khi độ xoắn của phình mạch tăng lên thì góc phình mạch sẽ giảm đi. Góc phình mạch nhỏ làm cho việc đặt stent-graft trở nên khó khăn.
Huyết khối thành trong lòng AAA là yếu tố không chỉ gây ra tiến triển và vỡ của AAA mà còn làm tăng nguy cơ mắc các biến cố tim mạch. Điều này có thể liên quan đến bạch cầu, các cytokine tiền viêm và các enzyme phân giải protein có trong gánh nặng huyết khối, có thể được giải phóng vào tuần hoàn .
Huyết khối thành trong lòng thường mềm và có thể bị vỡ trong quá trình EVAR gây tắc mạch ở xa.
CÁC MẠCH MÁU NHÁNH TỪ AAA
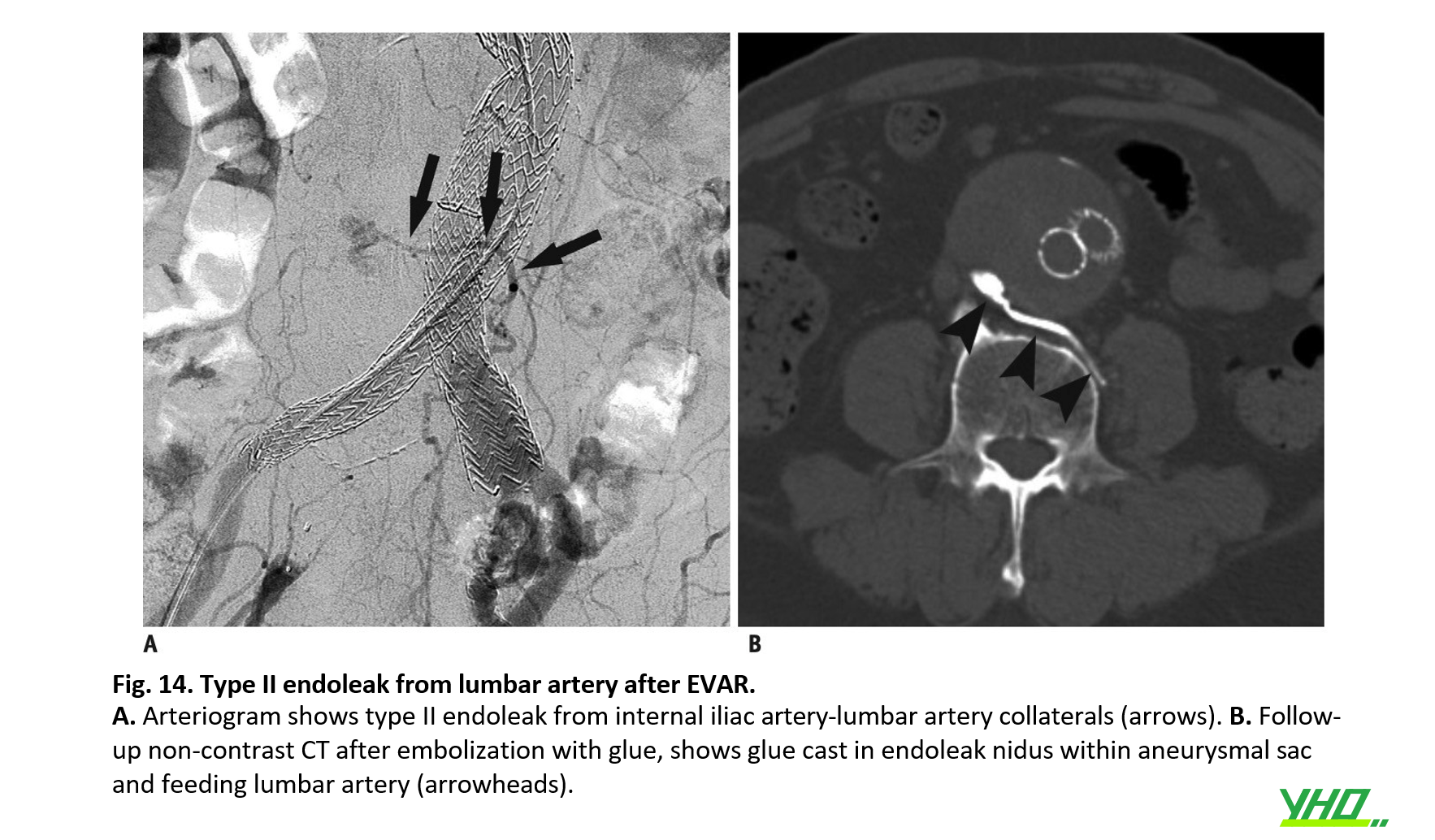
Các mạch máu nhánh từ AAA, bao gồm ĐM mạc treo tràng dưới, ĐM thắt lưng và ĐM cùng giữa, được coi là tuần hoàn bàng hệ chính gây ra rò rỉ týp II sau EVAR. Số lượng ĐM thắt lưng còn thông, ĐM mạc treo tràng dưới còn thông và diện tích mặt cắt ngang của ĐMC quanh lỗ của ĐM mạc treo tràng dưới là yếu tố dự báo rò rỉ (endoleak) týp II sau EVAR. Tuy nhiên, có những tranh cãi về việc có nên làm tắc dự phòng các mạch nhánh để ngăn chặn rò rỉ týp II.
Đường kính của đoạn xa động mạch chủ cũng cần được xem xét trong quá trình lập kế hoạch trước EVAR. Các hướng dẫn trước đây khuyến cáo rằng đường kính động mạch chủ ở đoạn xa phải lớn hơn 20 mm để đặt stent-graft có chia đôi. ĐMC đoạn xa hẹp là yếu tố nguy cơ chính gây tắc nhánh chia của stent và thiếu máu cục bộ chi cấp tính sau EVAR.
GIẢI PHẪU ĐM CHẬU VÀ ĐM ĐÙI
Độ quanh co và đường kính của ĐM chậu, sự hiện diện của mãng XVĐM dọc theo ĐM chậu và chiều dài của ĐM chậu chung nên được xem xét để thủ thuật thành công.
ĐM chậu xoắn vặn làm tăng nguy cơ tắc nhánh chia sau EVAR. Độ quanh co của động mạch chậu có thể được định lượng bằng cách sử dụng chỉ số xoắn vặn của ĐM chậu, xác định bằng cách chia khoảng cách dọc theo đường trung tâm từ chỗ chia đôi động mạch chủ đến động mạch đùi chung cho khoảng cách ngắn nhất. Chỉ số > 1.6 có thể được định nghĩa là xoắn vặn nghiêm trọng và việc đặt stent mạch máu bổ sung nên được xem xét để tăng cường sự thông suốt của stent sau EVAR .
Đường kính động mạch chậu nhỏ, đặc biệt do tổn thương xơ vữa động mạch kèm vôi hóa, có thể làm cho việc đưa hệ thống stent vào ĐMC bụng trở nên khó khăn. Trong trường hợp tắc hoàn toàn, EVAR với stent graft động mạch chủ-chậu đồng thời phẫu thuật bắc cầu đùi-đùi có thể được xem xét khi không thể đưa thiết bị qua được.
STENT GRAFT
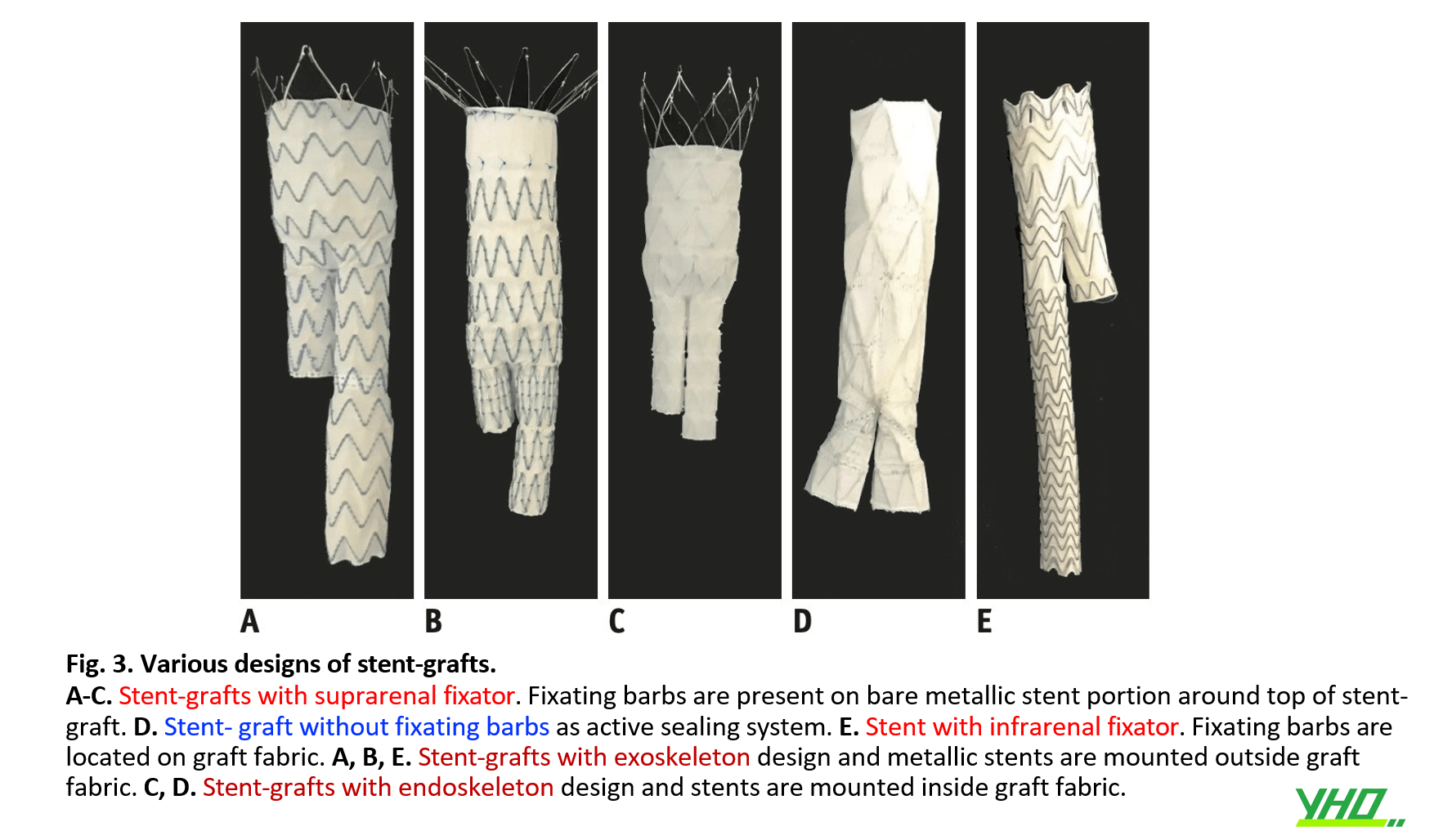
Các loại stent-graft rất đa dạng. Việc lựa chọn thiết bị phù hợp cho các AAA khác nhau cũng quan trọng như giải phẫu của AAA để có kết quả tốt sau EVAR
Dụng cụ cố định trên thận vs. Dụng cụ cố định dưới thận
Stent-graft có thể được chia thành hai nhóm dựa trên vị trí cố định của stent vào thành động mạch chủ.
- ✓Các dụng cụ cố định trên thận gắn stent-graft vào thành ĐMC ở đoạn trên thận, với các thanh chống hoặc ngạnh kim loại đặt trong phần stent trần phía trên phần stent-graft được phủ vải.
- ✓Các dụng cụ cố định dưới thận gắn stent-graft ở ĐMC bụng dưới thận, với ngạnh đặt trên phần phủ vải của stent (Hình 3).
Các stent-graft cố định trên thận được khuyến cáo trong AAA với cổ động mạch chủ gần không thuận lợi như cổ ngắn, góc cạnh hơn, cổ có vôi hóa và huyết khối ở thành, và cấu hình thon ngược.
Các stent-graft cố định dưới thận có thể được được dùng khi phần cổ ĐMC dài.
Endoskeleton vs. Exoskeleton
Stent-graft khung trong là một thiết bị có khung stent kim loại nằm bên trong vải ghép hình ống, trong khi stent-graft khung ngoài có khung stent kim loại bên ngoài vải ghép hình ống (Hình 3).
Mặc dù có rất ít sự khác biệt trong việc dùng điều trị phình mạch giữa hai thiết kế, stent-graft với thiết kế khung ngoài có thể liên quan đến việc tăng độ cứng động mạch, một trong những yếu tố tiên đoán độc lập cho các biến cố tim mạch bao gồm tăng huyết áp. Thiết kế stent-graft khung trong cho thấy tác dụng tối thiểu đối với độ cứng động mạch, điều này có thể dẫn đến giảm nguy cơ tổn thương cơ quan đích sau khi điều trị nội mạch.
THỦ THUẬT EVAR
Lập kế hoạch
Định cỡ và lập kế hoạch phù hợp là điều kiện tiên quyết cho thủ thuật EVAR tối ưu. Không chỉ giải phẫu của AAA mà cả vị trí tiếp cận cũng nên được xem xét trước thủ thuật
Việc đo lường trước khi thực hiện thủ thuật rất quan trọng để chọn được stent graft chính xác. Kích thước stent-graft được lựa chọn bằng cách đo đường kính của vùng gần và xa ĐMC lớn hơn khoảng 10–20% để cải thiện kết quả sớm sau EVAR. Đường kính của vùng đáp gần và xa nên được đo bằng cách sử dụng trục nhỏ từ rìa ngoài ra ngoài (từ rìa ngoài đến ngoài), ngay cả khi có sự hiện diện của huyết khối thành trong lòng động mạch.
Stent-graft quá lớn > 30% có thể liên quan đến việc dịch chuyển thiết bị và sự giãn nở muộn của túi phình (45). Đường kính động mạch chậu nên được xem xét để đảm bảo sự cố định ở phần xa và ngăn ngừa rò rỉ nội mạc do bịt kín phần xa không đủ. Độ cong của ĐM chậu và đường kính phân nhánh động mạch chủ cũng nên được xem xét để ngăn ngừa tắc nghẽn stent-graft sau khi cấy ghép do sự xoắn lại bất ngờ của stent.
Tiếp cận động mạch
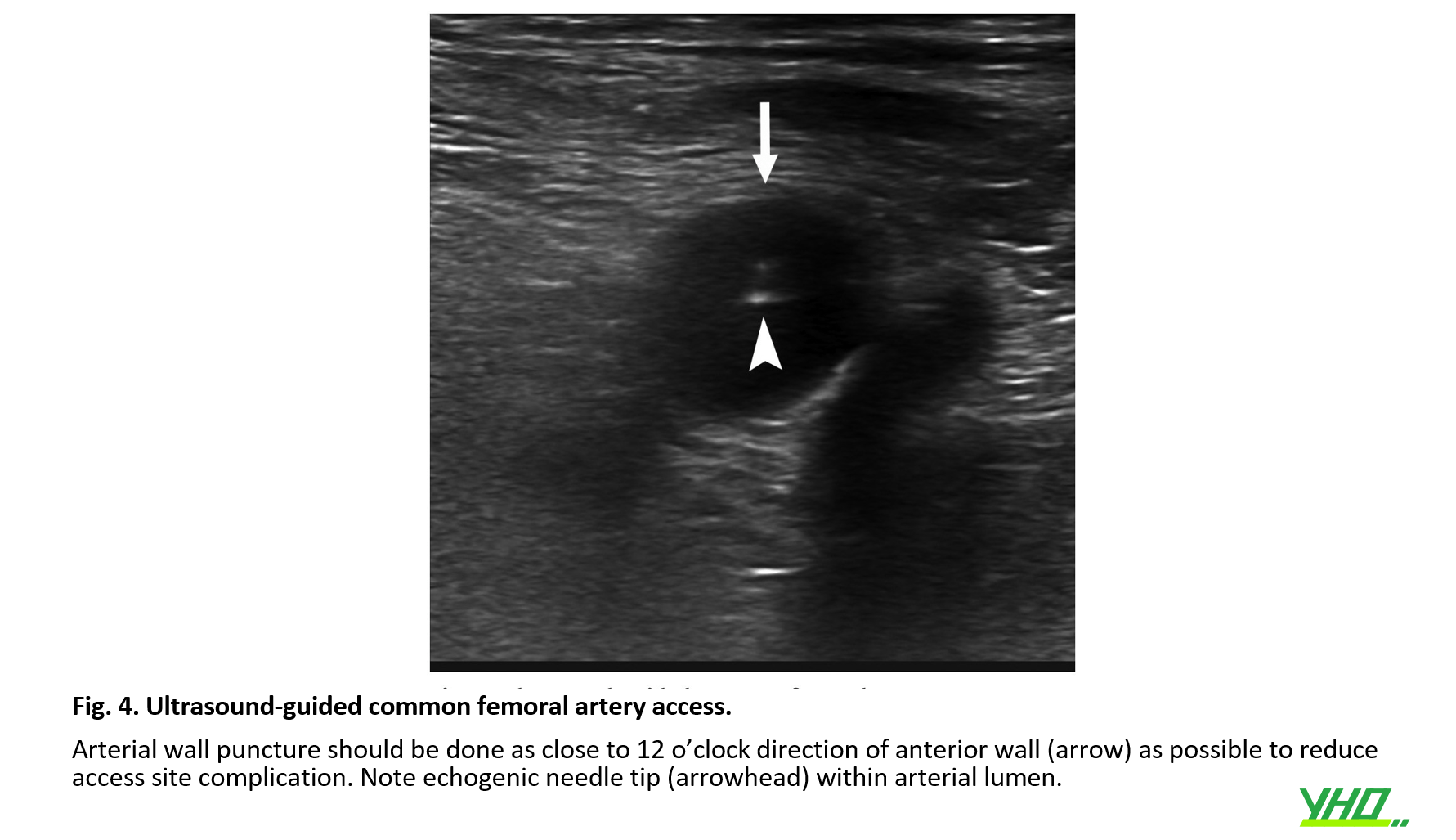
Mặc dù các hệ thống có kích thước nhỏ hơn hiện đã có sẵn, nhưng đường vào động mạch lớn , thường kích thước sheath > 12-Fr, vẫn là tiêu chuẩn cho EVAR so với các thủ thuật nội mạch khác. Do đó, việc tiếp cận động mạch đùi được coi là cần thiết cho EVAR thành công.
Nên đặt sheath động mạch đùi chung dưới hướng dẫn của siêu âm (Hoa Kỳ) để đâm kim chính xác và có thể làm giảm biến chứng tại vị trí tiếp cận. Siêu âm giúp hình dung trực tiếp động mạch đùi chung và chỗ chia đôi động mạch đùi.
Cũng có thể xác nhận vị trí đâm kim thích hợp (khoảng 12 giờ) ở thành động mạch không bị vôi hóa động mạch bằng siêu âm (Hình 4).
PEVAR có thể được thực hiện dưới hình thức an thần có ý thức hoặc gây tê tại chỗ. Đánh giá của siêu âm về động mạch đùi chung hai bên và việc tiếp cận động mạch dưới hướng dẫn siêu âm là điều tối quan trọng để thành công. Nên tránh chọc xuyên thành chổ ĐM bị vôi hóa. Đối với PEVAR, thiết bị đóng mạch Proglide (Abbott Medical, Abbott Park, IL, USA) thường được yêu cầu cho mỗi vị trí tiếp cận động mạch đùi chung.
PEVAR không thua kém phẫu thuậ. Đánh giá hồi cứu 4112 bệnh nhân trải qua PEVAR hoặc phẫu thuật cho thấy PEVAR có thời gian phẫu thuật ngắn hơn, thời gian nằm viện ngắn hơn và ít biến chứng hơn. Mặc dù có thêm chi phí liên quan đến thiết bị đóng mạch, PEVAR có thể tiết kiệm chi phí do giảm thời gian nằm viện, giảm thiểu chấn thương do phẫu thuật cũng như tăng sự hài lòng của BN vì ít đau và thẩm mỹ hơn.
PEVAR không cần gây mê toàn thân và có thể được thực hiện nhanh chóng nên có thể được thực hiện thành công với những BN không ổn định do vỡ AAA.
Nếu không có chống chỉ định, PEVAR là phương pháp điều trị EVAR chủ yếu ở cả BN ổn định và không ổn định.
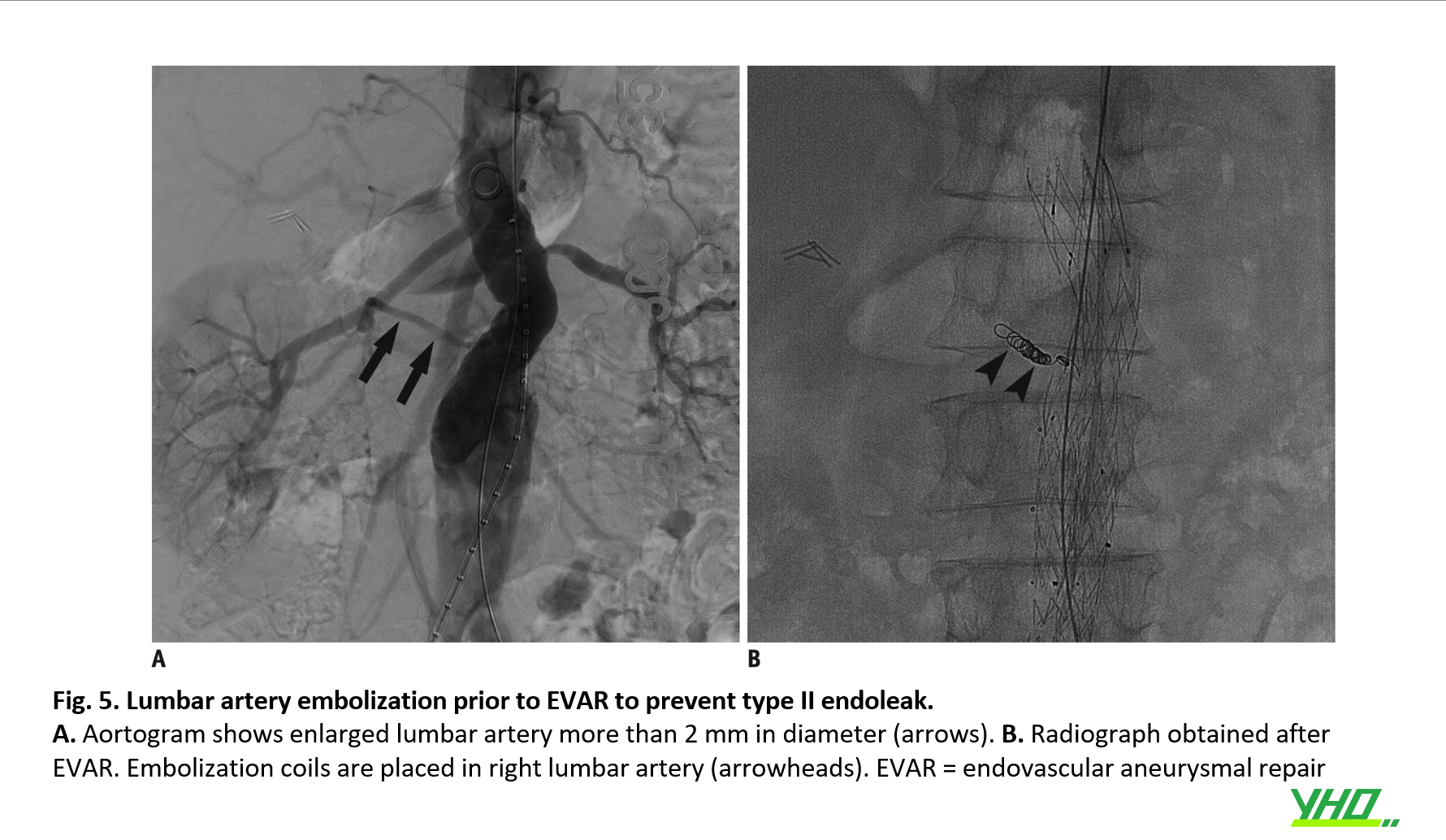
Thuyên tắc mạch nhánh
Các nhánh mạch từ AAA có thể được thuyên tắc trước EVAR để ngăn chặn áp lực ngược và dai dẳng ở túi phình sau khi đặt stent-graft. Các mạch nhánh này bao gồm ĐM thận phụ, ĐM mạc treo tràng dưới, ĐM thắt lưng và ĐM chậu trong (IIA). Hơn nữa, để mở rộng sự cố định ở phần xa của động mạch chậu ngoài, việc tắc IIA theo kế hoạch có thể được thực hiện một bên hoặc hai bên.
Mặc dù hiệu quả của thuyên tắc phòng ngừa các nhánh động mạch chủ còn gây tranh cãi, những BN có đường kính ĐM mạc treo tràng dưới > 3,0 mm hoặc đường kính ĐM thắt lưng > 2,0 mm có thể là đối tượng được thực hiện thuyên tắc phòng ngừa (Hình 5).
Tắc IIA có nguy cơ biến chứng thiếu máu cục bộ đáng kể ở khoảng 25% BN. Tỷ lệ biến chứng TMCB sau tắc IIA hai bên cao hơn đáng kể. Để giảm tỷ lệ biến chứng, (1) có thể thực hiện thuyên tắc vài tuần trước EVAR để có thời gian phát triển mạch bàng hệ nhằm giảm nguy cơ TMCB vùng chậu, đặc biệt đối với những BN đang cân nhắc thực hiện thuyên tắc IIA hai bên. (2) có thể sử dụng kỹ thuật bảo tồn IIA như ghép nhánh chậu hoặc các kỹ thuật tiên tiến khác (ví dụ: kỹ thuật kẹp)
THỦ THUẬT EVAR
Mặc dù các bước của quy trình có thể khác nhau tùy theo hệ thống và nhà sản xuất stent-graft, quy trình EVAR có thể được tóm tắt như sau:
1)tiếp cận động mạch đùi chung,
2)chụp động mạch chủ cản quang đầy đủ để xác nhận chiều dài của đoạn phình động mạch bằng ống thông đã được hiệu chỉnh,
3)thủ thuật phụ trợ như tắc mạch nhánh, nếu được chỉ định,
4)đưa sheath lần lượt qua dây dẫn cứng,
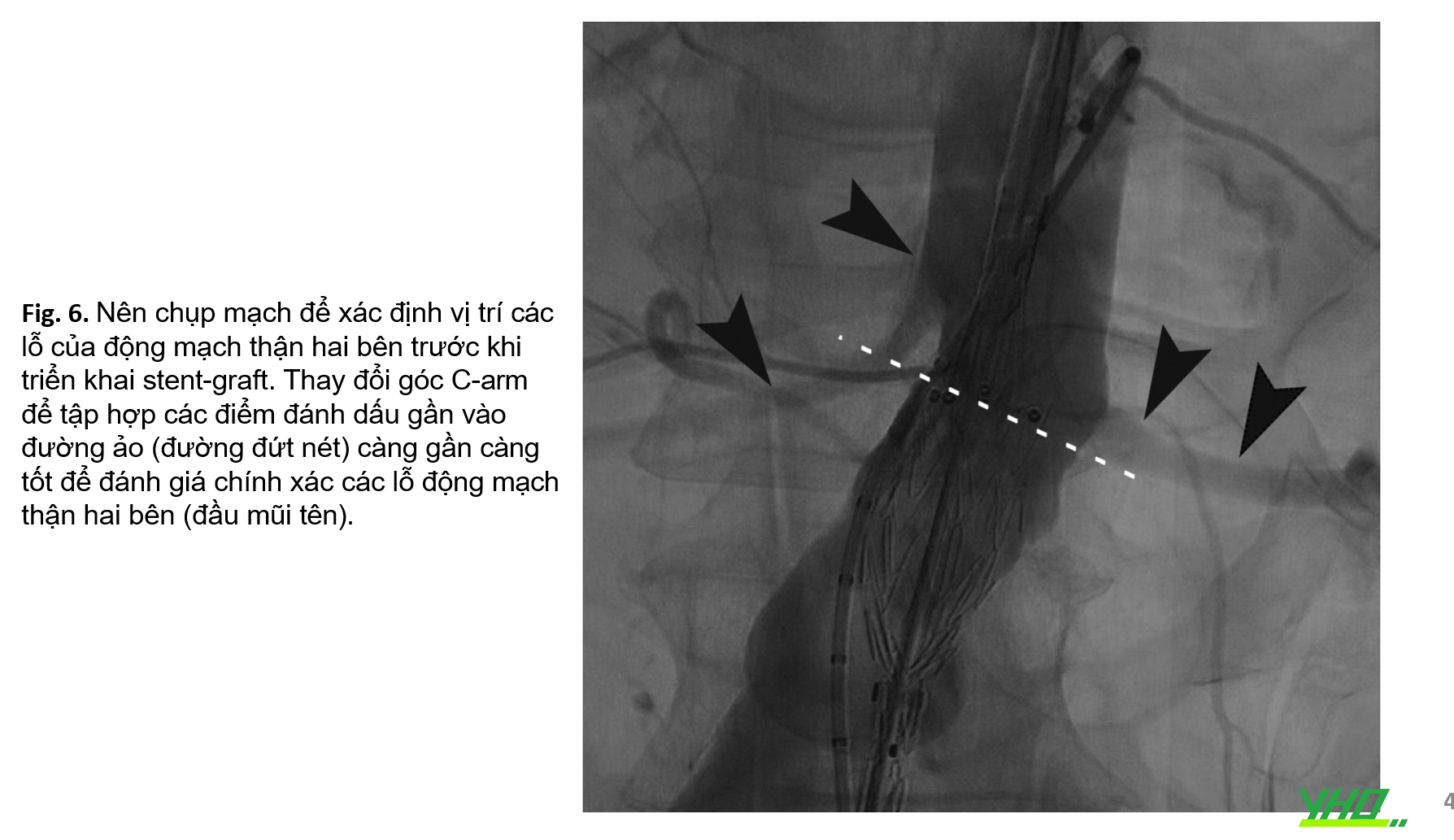
5)xác nhận lỗ của động mạch thận hai bên sau khi đưa hệ thống thân chính stent-graft vào phần cổ gần,
6)triển khai thân chính stent graft,
7)đặt ống luồn từ vị trí tiếp cận động mạch đùi chung đối bên để đặt stent graft chi đối bên,
8)Triển khai stent graft chi bên đối diện sau khi xác nhận chiều dài của stent graft ,
9)Đặt stent graft chi cùng bên sau khi xác nhận lỗ IIA,
10)Nong bóng phù hợp để mở rộng và gắn stent-graft vào thành mạch tự nhiên ở cả hai đầu gần và xa cũng như tại điểm ghép chồng lên nhau,
11)chụp động mạch chủ hoàn chỉnh để tìm bất kỳ rò rỉ lớn nào sau EVAR và để xác nhận tính thông suốt của tất cả các thành phần của stent-graft.
Ống thông và sheath cho phần thân chính thường lớn hơn so với bên chi đối diện. Do đó, nên chọn các ĐM chậu đùi lớn hơn để làm bên chính. Do dây dẫn để đưa sheath và hệ thống stent-graph cực kỳ cứng, ngoại trừ đầu tận cùng, không nên luồn dây dẫn quá nhiều và cần theo dõi cẩn thận vị trí của đầu dây dẫn trong suốt quá trình thủ thuật.
Xác định chính xác lỗ động mạch thận là bước rất quan trọng để bảo tồn tưới máu thận. Chọn góc thích hợp bằng cách thay đổi góc C-arm để cân chỉnh các điểm đánh dấu trên cùng của stent với một đường ảo (Hình 6). Mặc dù hệ thống phân phối đang được cải tiến về mặt kỹ thuật nhưng việc di chuyển stent-graft sau khi đã thả vẫn gặp khó khăn. Việc đặt mảnh ghép thân chính phải được thực hiện cẩn thận, đặc biệt ở những BN có cổ gần gập góc.
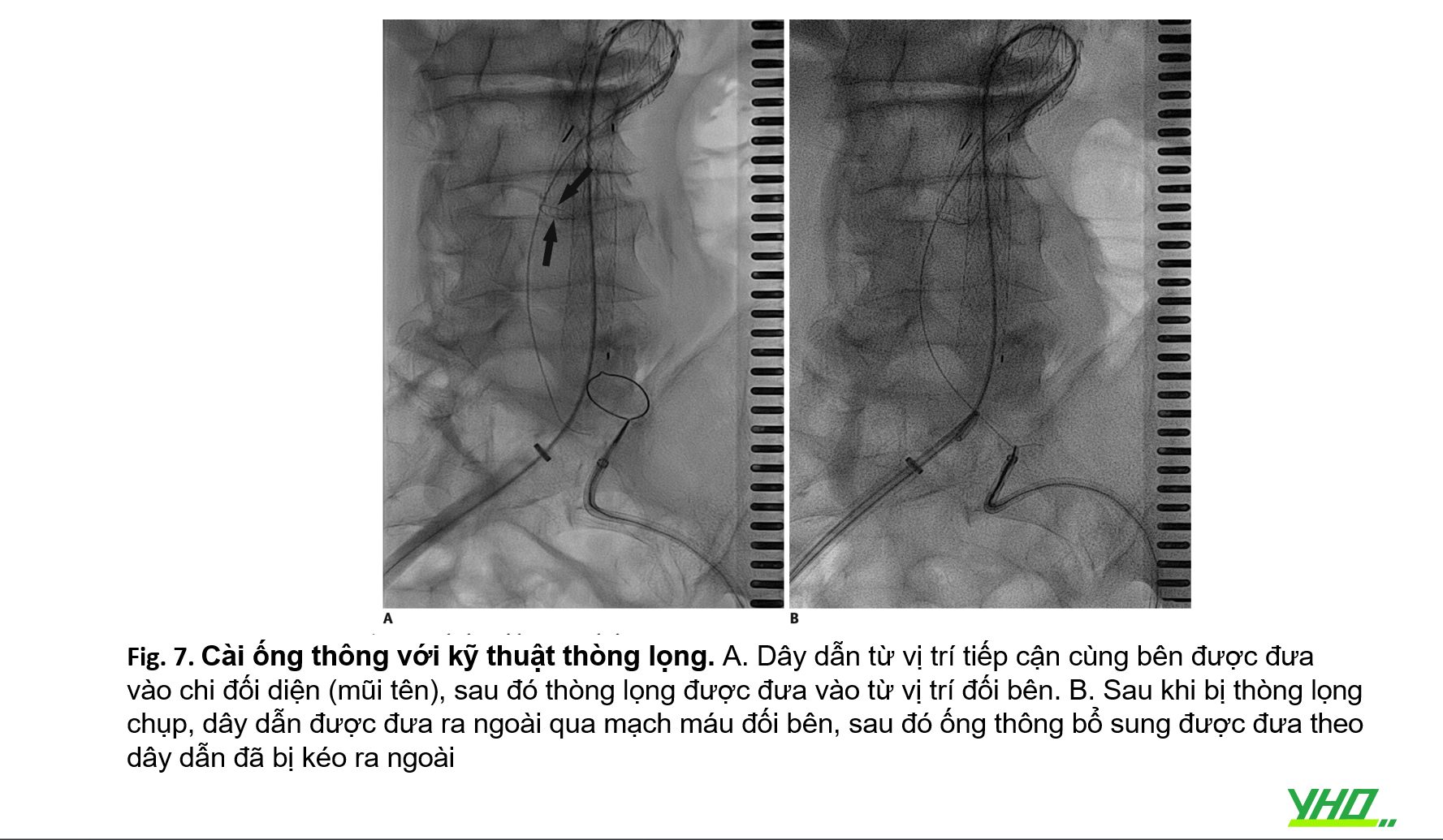
Cài ống thông cho stent graft chi đối diện cũng đòi hỏi kỹ thuật cao và là một bước tốn thời gian, đặc biệt ở những BN có ĐM chậu lớn hoặc động mạch chậu rất ngoằn ngoèo. Nếu không thành công, có thể dùng kỹ thuật sử dụng thòng lọng (snare) thông qua bên đối diện (Hình 7).
Kỹ thuật EVAR nâng cao
Kỹ thuật EVAR nâng cao là kỹ thuật được sử dụng cho AAA không phù hợp về mặt giải phẫu với EVAR thông thường.
Kỹ thuật ống khói và kỹ thuật kính tiềm vọng (Chimney technique and periscope technique) có thể được thực hiện trong trường hợp đoạn gần vùng đặt stent graft khó khăn.
Stent-graft tùy chỉnh, Stent-graft có cửa sổ hoặc có nhánh cũng có thể được sử dụng cho khu vực đáp stent-graft không đạt yêu cầu.
Việc thiếu dữ liệu dài hạn và sự phức tạp của thủ thuật là những trở ngại cho việc quyết định và thực hiện các kỹ thuật nâng cao này.
BIẾN CHỨNG EVAR
Các biến chứng có thể xảy ra trong hoặc sau EVAR. Chấn thương mạch máu, các biến chứng liên quan đến đặt stent không đúng cách và hội chứng sau cấy ghép có thể xảy ra trong hoặc ngay sau EVAR. Trong quá trình theo dõi, có thể quan sát thấy sự di chuyển stent , rò rỉ nội mạch( endoleak), tắc mạch nhánh chi của stent graft và nhiễm trùng.
Tổn thương mạch máu tiếp cận
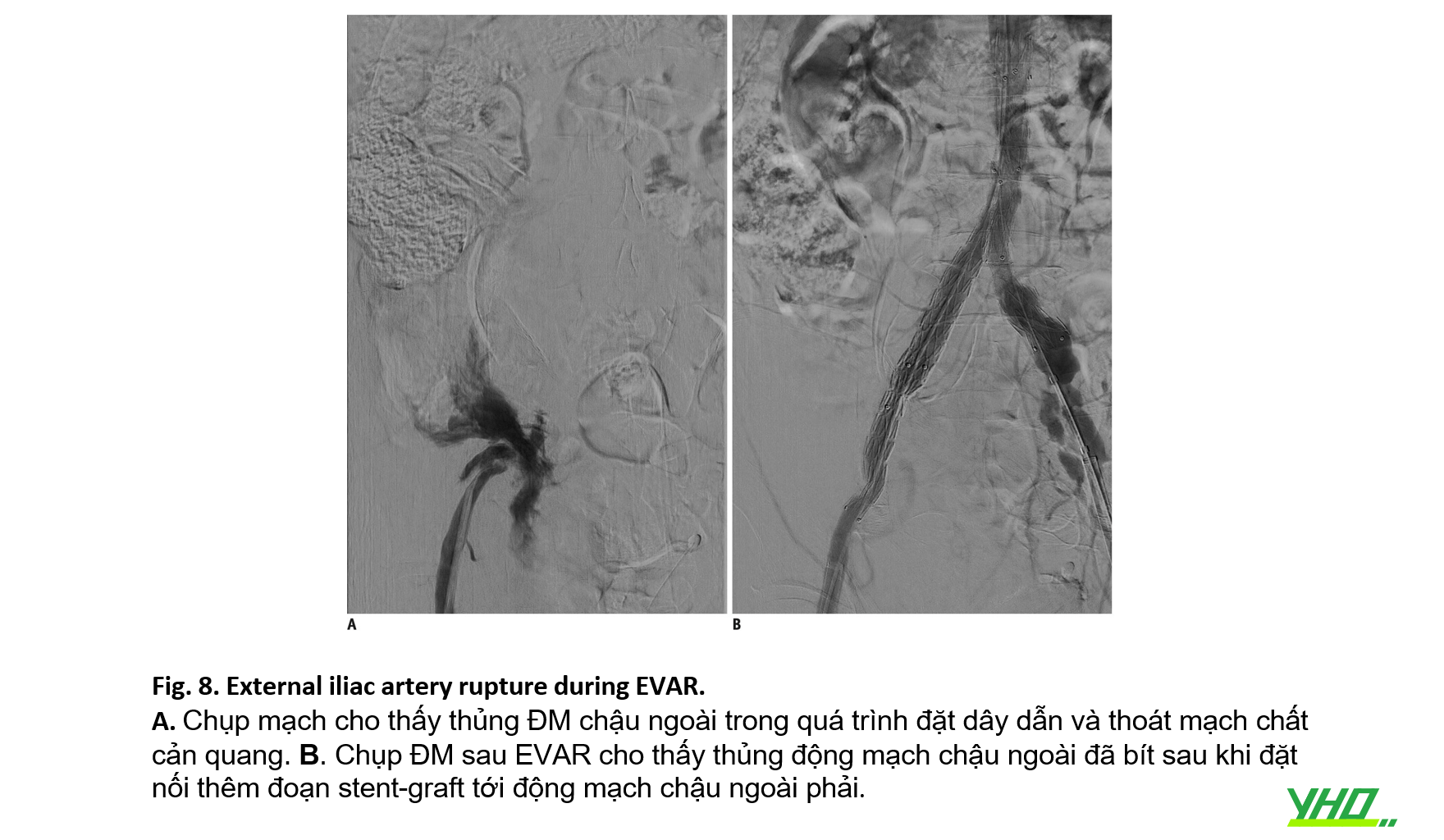
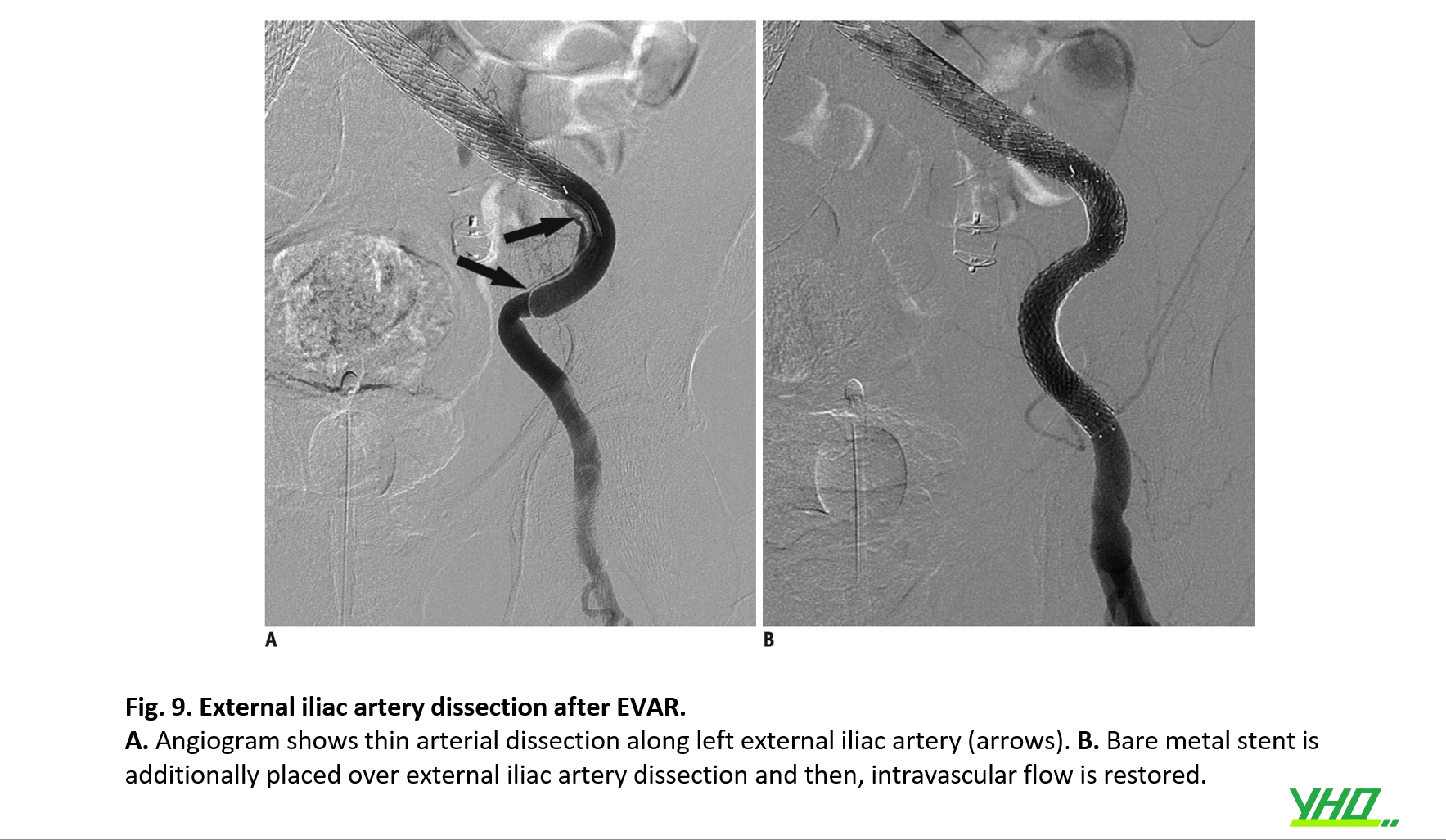
Tổn thương mạch máu, bao gồm tổn thương ĐM chậu và ĐM đùi chung có thể xảy ra. Vỡ hoặc bóc tách động mạch chậu cũng có thể xảy ra trong quá trình tiếp cận mạch máu hoặc thủ thuật EVAR bằng hệ thống stent-graft hoặc sheath lớn. Vôi hóa mạch máu, đường kính nhỏ và tình trạng xoắn vặn nghiêm trọng của động mạch chậu liên quan đến việc tăng tỷ lệ tổn thương mạch máu tiếp cận. Vỡ động mạch chậu trong EVAR có liên quan đến tỷ lệ tử vong cao và thời gian nằm viện tăng lên (Hình 8) và bóc tách động mạch chậu có thể gây tắc chi sớm (Hình 9). Do đó, việc triển khai stent-graft kịp thời nên được xem xét đối với trường hợp vỡ động mạch chậu và cần đặt stent mạch máu bổ sung khi có bóc tách động mạch chậu..
Đặt Stent-Graft không chính xác
Việc đặt chính xác stent-graft ở đoạn gần cổ động mạch chủ là rất quan trọng để đạt được kết quả thành công sau EVAR cũng như để duy trì tưới máu qua các nhánh bên. Đặt stent- graft không đúng cách thường gặp hơn trong giải phẫu vùng cổ đoạn gần, đặc biệt khi có gập góc.
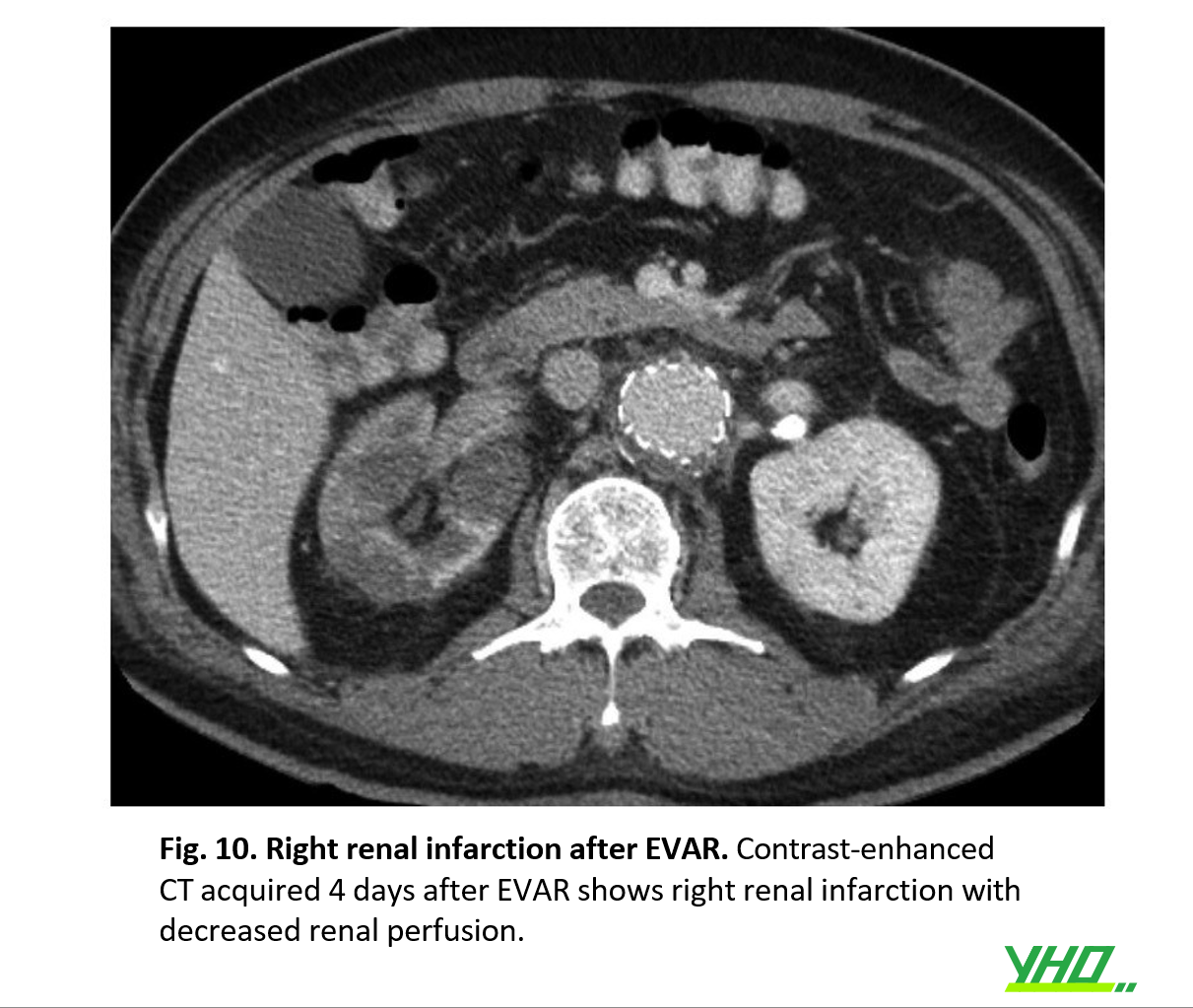
Nếu stent được đặt quá cao ở đoạn gần cổ động mạch chủ, động mạch thận có thể bị tắc và gây biến chứng thiếu máu cục bộ ở thận (Hình 10). Ngược lại, nếu stent được đặt quá thấp ở phần cổ gần, đặc biệt ở những bệnh nhân có cổ mở rộng, sự di chuyển về phía dưới của stent-graft có thể xảy ra trong hoặc ngay sau EVAR, dẫn đến rò rỉ lớn loại Ia. Để ngăn chặn việc đặt stent graft không chính xác, bắt buộc phải tạo góc C-arm phù hợp và đánh giá cẩn thận về vị trí của phần cổ đoạn gần.
Hội chứng sau cấy ghép
Hội chứng sau cấy ghép là một phản ứng viêm sau EVAR. Hội chứng sau cấy ghép có thể được chẩn đoán khi sốt (> 38°C) kéo dài hơn 1 ngày kèm theo tăng bạch cầu (số lượng bạch cầu > 12000 μL) và cấy máu âm tính. Các triệu chứng của hội chứng sau cấy ghép có bản chất giống như cúm và biểu hiện trên lâm sàng là phản ứng viêm toàn thân, đặc trưng bởi sốt, tăng bạch cầu và CRP, tnf-alpha và nồng độ interleukin-6. Tỷ lệ mắc hội chứng sau cấy ghép dao động từ 13 – 60% .
Các yếu tố sinh lý bệnh được đề xuất: tổn thương nội mô trong EVAR, sự di chuyển của vi khuẩn do thiếu máu cục bộ đại tràng sigmoid thoáng qua, sự thoái hóa bạch cầu trung tính do thuốc cản quang, dụng cụ nội mạch gây huyết khối ở thành mạch, sự phát triển của huyết khối mới trong túi phình sau khi đặt stent, và một loại vải ghép cụ thể, đặc biệt là trong ống ghép được làm bằng vải dệt (woven polester).
Diễn biến lâm sàng của hội chứng sau cấy ghép thường lành tính và điều trị chỉ bao gồm theo dõi và dùng aspirin để giảm viêm. Tuy nhiên, các loại thuốc chống viêm tích cực bao gồm steroid có thể được yêu cầu khi bệnh nhân có các triệu chứng viêm lan rộng. Thuốc kháng sinh thường không cần thiết trong hầu hết các trường hợp.
Di chuyển Stent-Graft
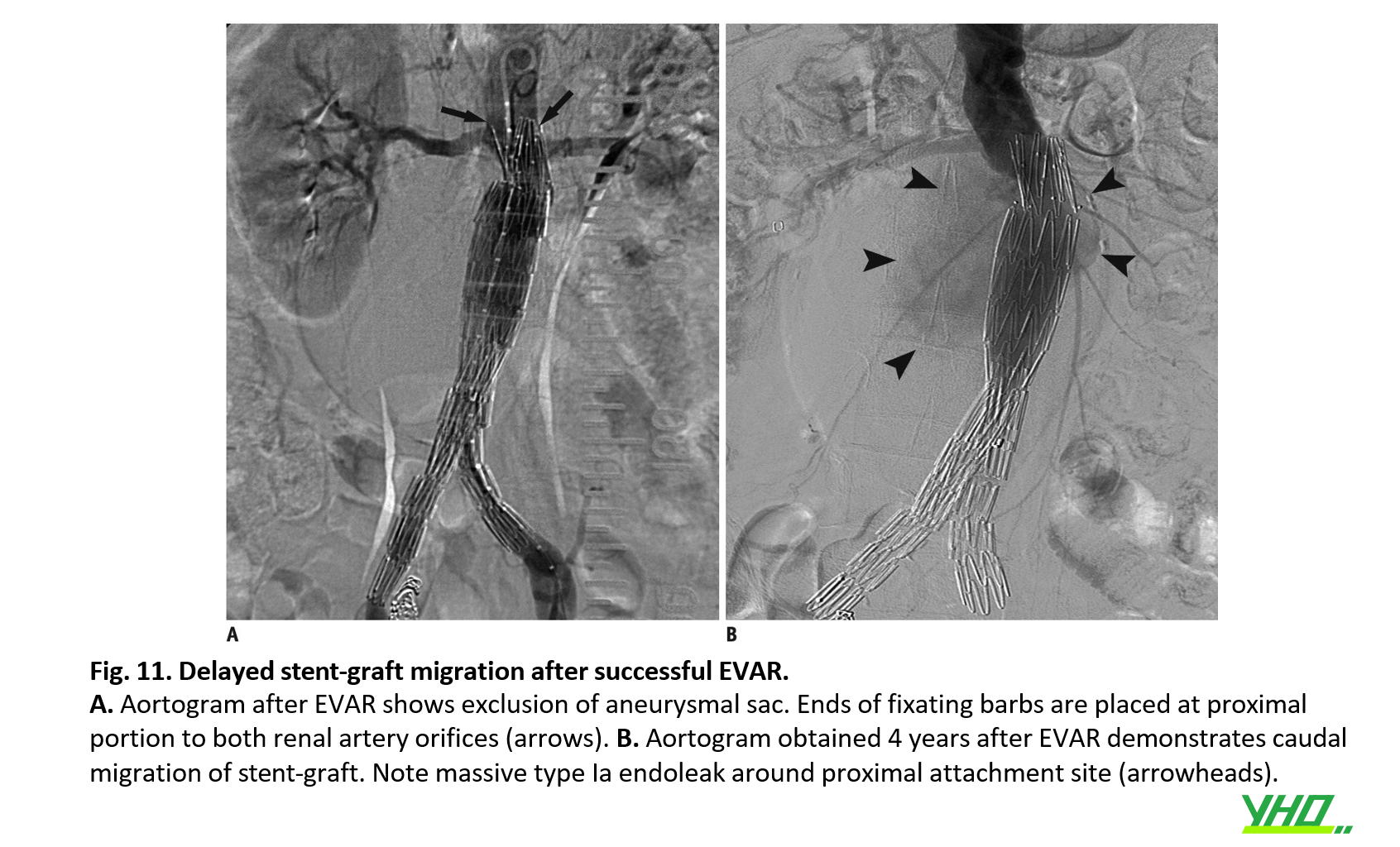
Sự dịch chuyển của stent-graft > 5–10 mm so với vị trí cố định ban đầu được định nghĩa là sự dịch chuyển của stent-graft. Dịch chuyển stent-graft gần là một biến chứng âm thầm và muộn, có thể dẫn đến rò rỉ loại Ia, tái phát triển AAA và cuối cùng là vỡ phình động mạch gây tử vong. Dịch chuyển stent-graft gần và rò rỉ loại Ia khởi phát muộn có thể xảy ra bất cứ lúc nào ngay cả sau khi EVAR thành công, đòi hỏi phải theo dõi suốt đời (Hình 11).
AAA lớn với cổ ngắn và góc cạnh được điều trị đặc biệt bằng phiên bản cũ của stent- graft cho thấy nguy cơ di chuyển đoạn gần stent-graft cao hơn. Hầu hết việc di chuyển stent đến đoạn gần có thể được quản lý bằng các phương pháp nội mạch như mở rộng đoạn gần bằng vòng bít động mạch chủ hoặc stent có thể phồng lên bằng bóng lớn để tăng cường áp stent vào thành ĐMC. Gần đây, endoanchors có thể được sử dụng để cố định stent-graft trên thành động mạch chủ nhằm ngăn chặn sự di chuyển của stent- graft trong trường hợp AAA có cổ ngắn (<10 mm). Thủ thuật này cũng có thể được thực hiện để phòng ngừa.

Rò rĩ nội mạch (Endoleaks) là nguyên nhân phổ biến nhất dẫn đến can thiệp thứ cấp sau EVAR. Xử trí ban đầu đối với rò rỉ loại Ia là gắn thêm stent-graft vào đoạn gần ĐMC với một quả bóng lớn có độ đàn hồi cao. Stent kim loại bung bằng bóng lớn hoặc vòng bít ĐMC có thể được áp dụng để gia cố và mở rộng vùng bịt kín ở đầu gần.
Việc chuyển sang phẫu thuật không được khuyến khích trừ khi xảy ra tình trạng vỡ do đặt stent-graft không đúng cách đáng kể và không thể sửa chữa được (7).
Đối với rò rỉ nội mạch loại Ia dai dẳng, các kỹ thuật nội mạch khác như gây tắc mạch bằng chất gây tắc mạch lỏng (N-butyl cyanoacrylate hoặc chất đồng trùng hợp rượu ethylene vinyl) hoặc coil, kỹ thuật ống khói cho động mạch thận và ghép stent nhánh hoặc chuyển mỗ có thể được xem xét.
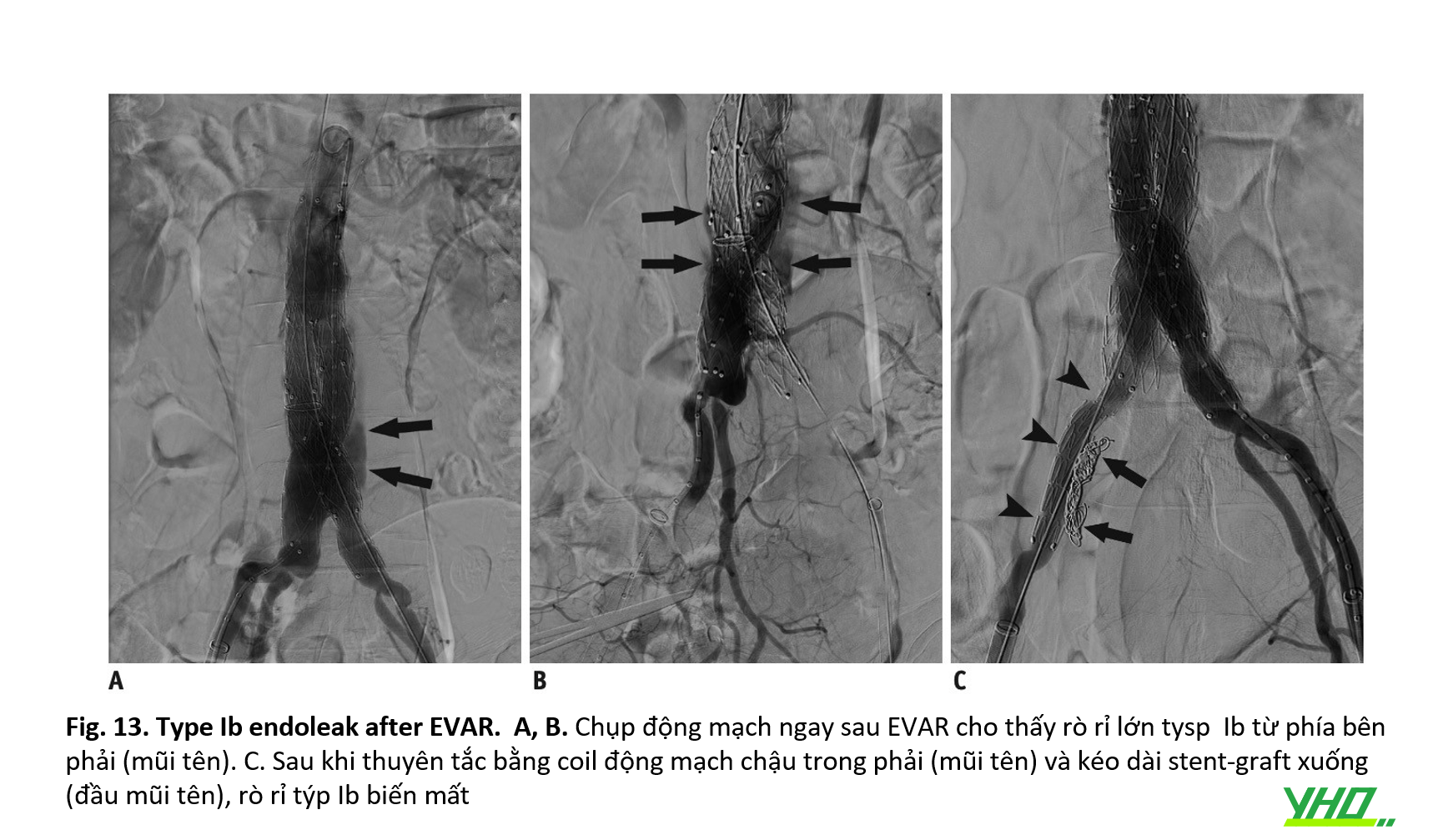
Rò rỉ loại Ib có thể được kiểm soát bằng cách gắn stent-graft lặp đi lặp lại vào thành mạch bằng một quả bóng đàn hối. Việc kéo dài stent-graft đến ĐM chậu ngoài cũng có thể được thực hiện để điều trị rò rỉ loại Ib.
Thuyên tắc để điều trị rò týp IIA có thể được áp dụng trong trường hợp kéo dài stent ghép tới ĐM chậu ngoài (Hình 13).
Xử lý Endoleak loại II được chỉ định khi tình trạng rò rỉ tiếp tục tồn tại kèm với sự giãn nở liên tục của túi phình. Nên thực hiện thuyên tắc các nhánh bên đóng vai trò là đường truyền máu (Hình 14).
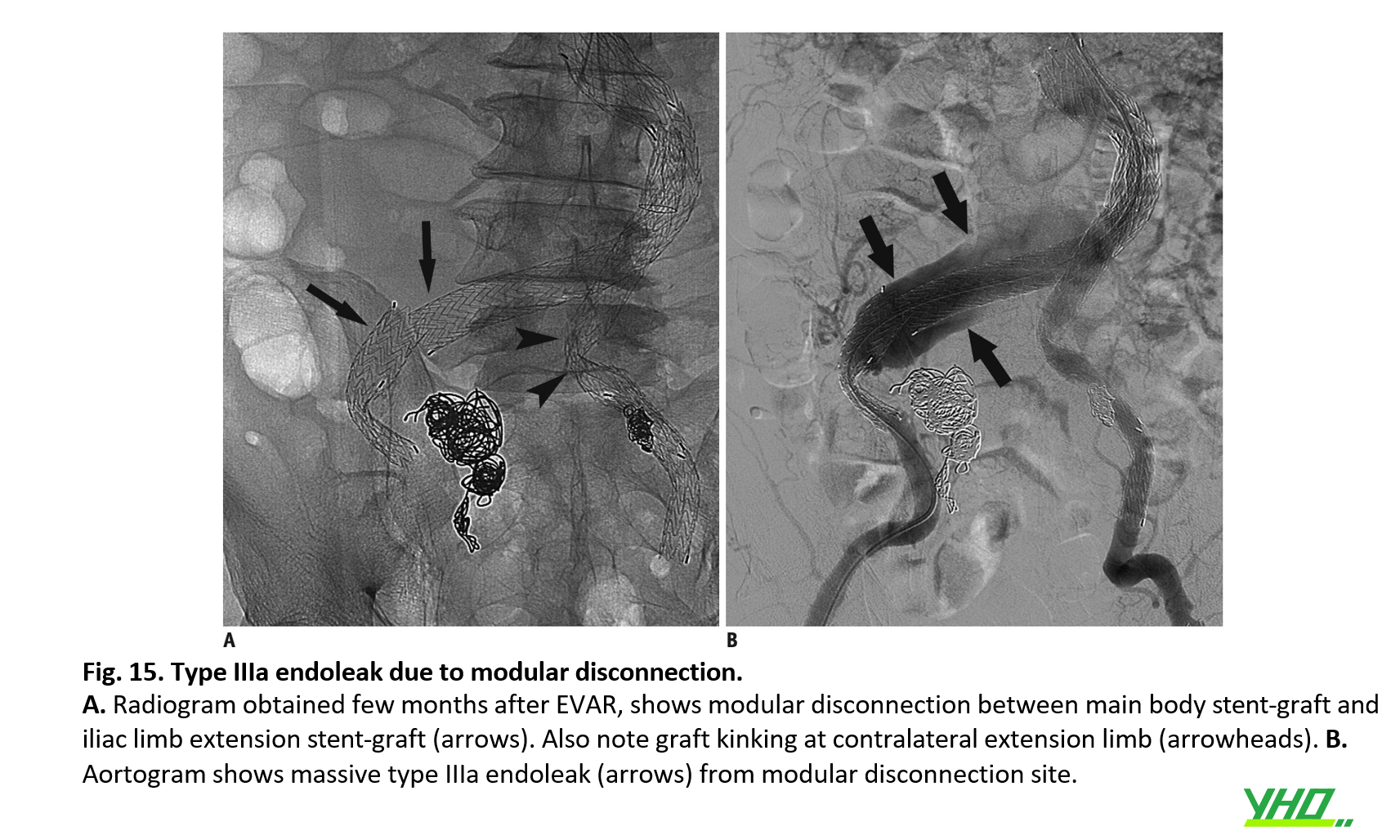
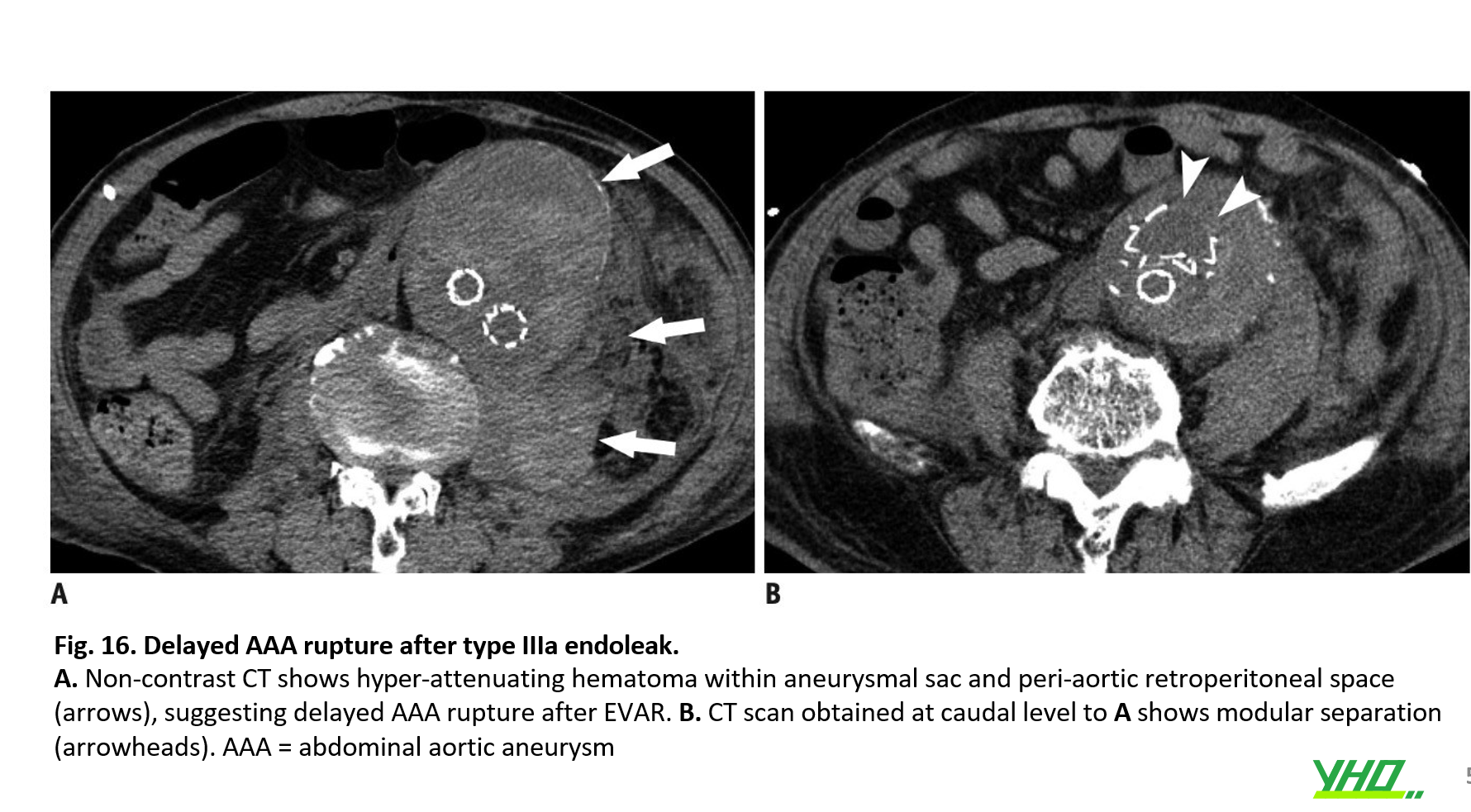
Với sự ra đời của thế hệ stent-graft mới, tỷ lệ rò rỉ nội týp III giảm đáng kể. Mặc dù tỷ lệ rò rỉ nội týp III thấp hơn so với rò rỉ nội týp I hoặc II, rò rỉ nội týp III được coi là nguy hiểm vì nó tăng nguy cơ vỡ ĐMC (Hình 15, 16). Rò rỉ týp III có thể được quản lý bằng các kỹ thuật nội mạch như đặt thêm stent-graft lên trên chỗ mất kết nối hoặc bơm bóng ở các vùng chồng lên nhau để đảm bảo kết nối các mô-đun.
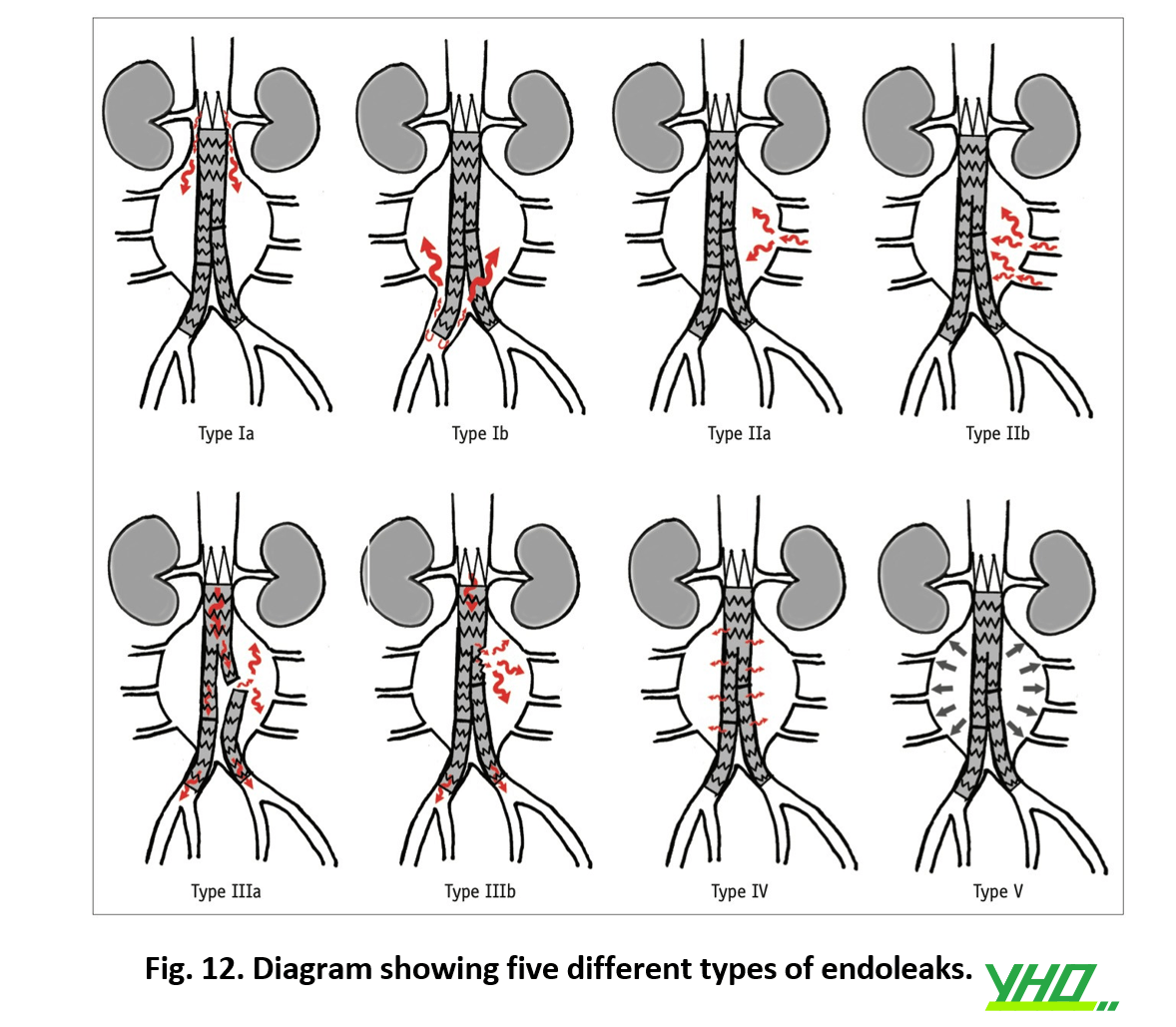
Rò rỉ týp IV thường tự giới hạn và không cần điều trị.
Đối với rò rỉ týp V, nên xem xét tái lót nội mạch bằng cách ghép stent bổ sung hoặc chuyển đổi phẫu thuật nếu túi phình phát triển liên tục.
Tắc mạch chi cấp tính
Tắc nghẽn chi cấp tính được báo cáo ở 0,4–11,9% BN EVAR để điều trị AAA
Thế hệ stent-graft mới có thể làm giảm tỷ lệ mắc , nhưng tắc chi cấp tính vẫn là một trong những nguyên nhân chính gây ra can thiệp thứ cấp, nằm viện kéo dài và tử vong sau EVAR . Các nguyên nhân gây tắc mạch chi bao gồm stent graft quá lớn, xoắn stent trong chỗ khúc khuỷu của chậu, bóc tách ở động mạch chậu ngoài và tổn thương ở vị trí tiếp cận động mạch.
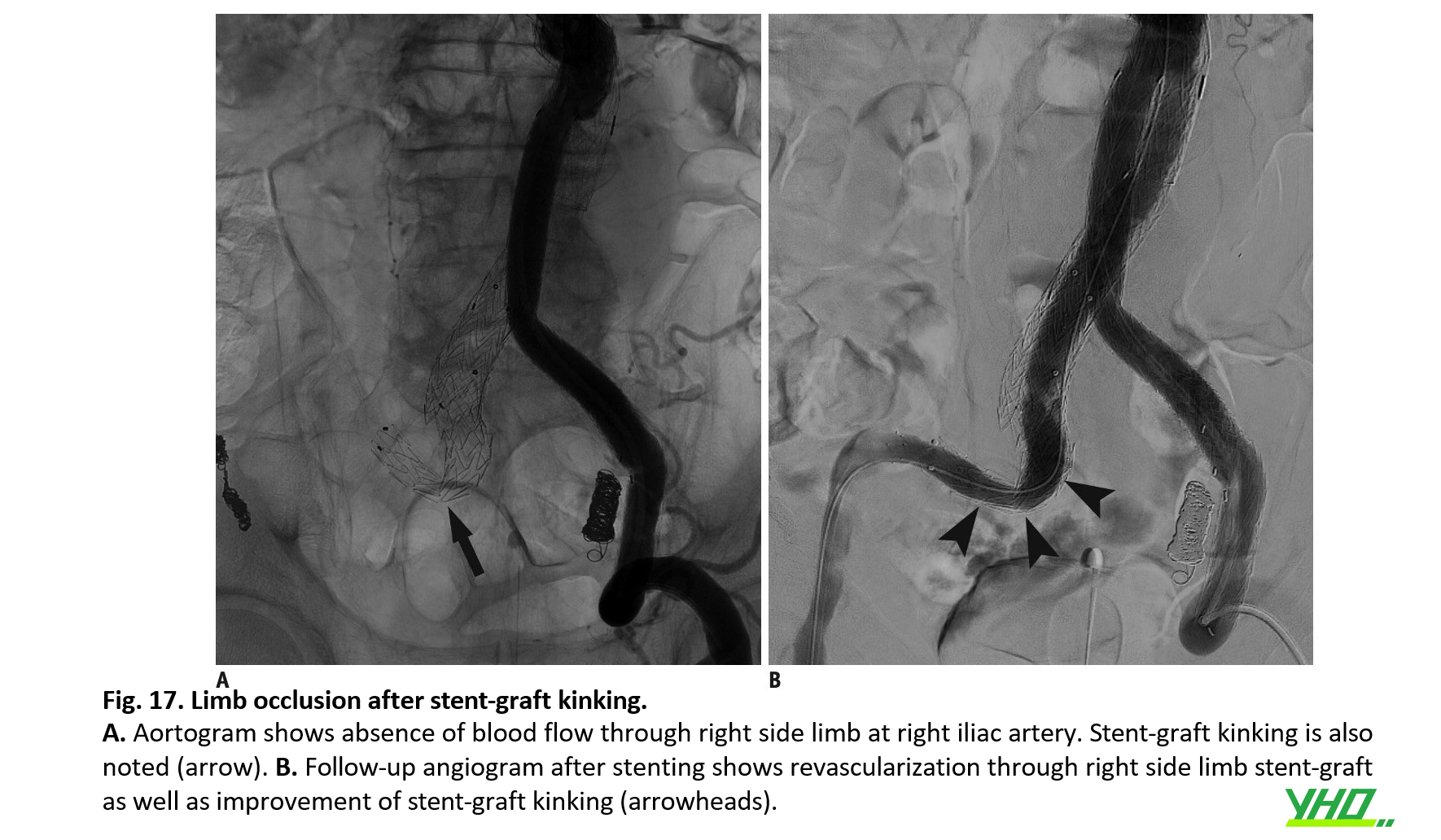
Tắc chi cấp tính sau EVAR có thể được điều trị bằng phương pháp nội mạch hoặc phẫu thuật. Các phương pháp nội mạch bao gồm stent-graft, đặt stent gia cố trên phần nhánh chia bị xoắn của stent-graft, nong mạch hoặc đặt stent bổ sung để điều trị tắc nghẽn đường ra, và tái thông mạch máu cho nhánh chia bị tắc bằng stent trần hoặc lót lại bằng stent-graft (Hình 17).
Tiêu huyết khối qua ống thông hoặc hút huyết khối đôi khi có thể được thực hiện mặc dù có nguy cơ tắc mạch ở đầu xa mạch máu .
Các lựa chọn phẫu thuật bao gồm bắc cầu đùi-đùi, bắc cầu nách-đùi và phẫu thuật loại bỏ huyết khối.
Nhiễm trùng Stent-Graft
Nhiễm trùng stent-graft được báo cáo ở 0,3–3,6% BN EVAR. Tỷ lệ tử vong do nhiễm trùng stent ghép cao và dao động từ 25% đến 50%. Nguyên nhân gây nhiễm trùng khác nhau tùy thời điểm xuất hiện. Nhiễm trùng trong quá trình thủ thuật khởi phát sớm. Nhiễm trùng ở đường vào xa và sự phát triễn vi khuẩn ở stent- graft có thể là nguyên nhân gây nhiễm trùng stent-graft muộn.
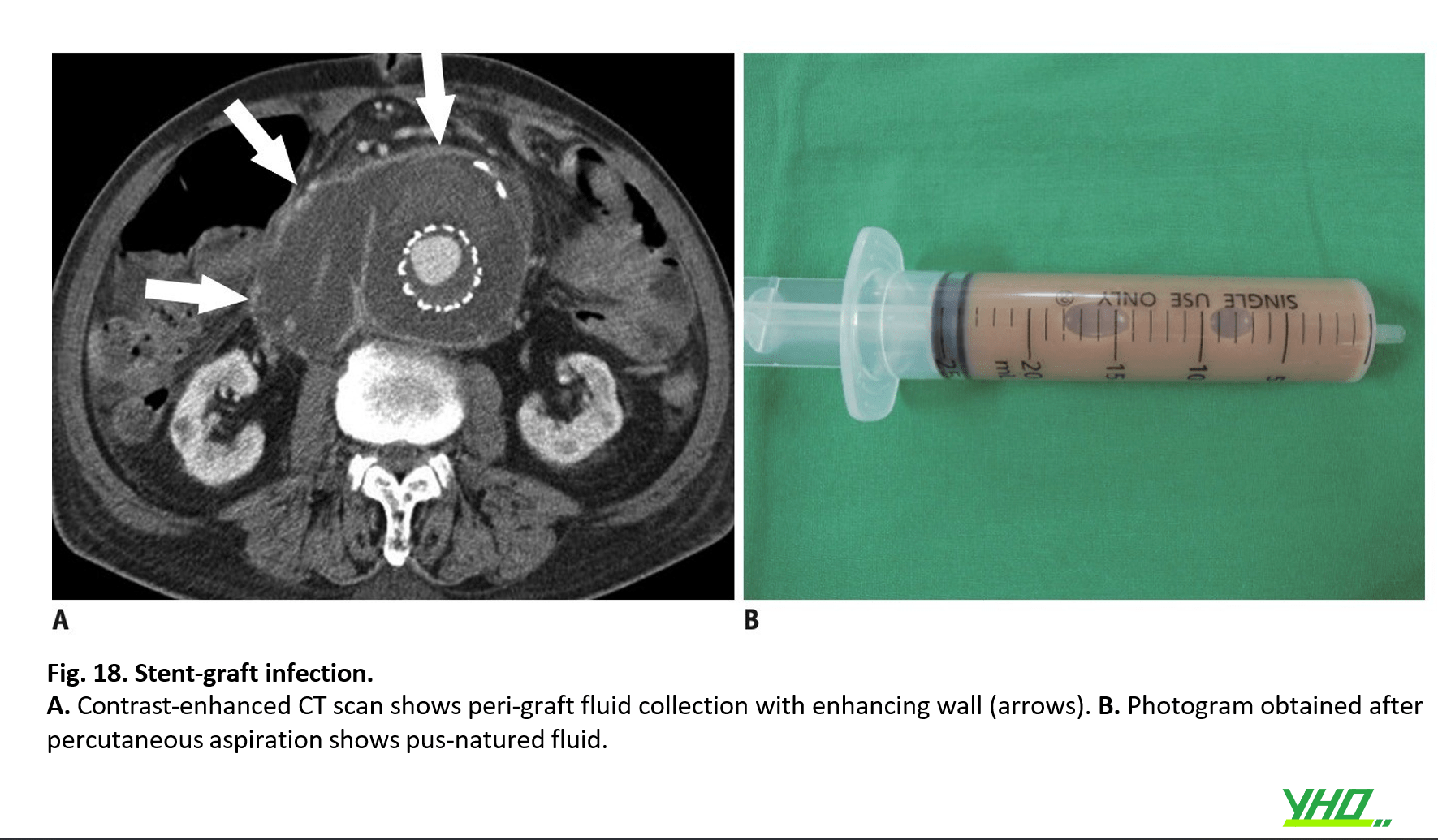
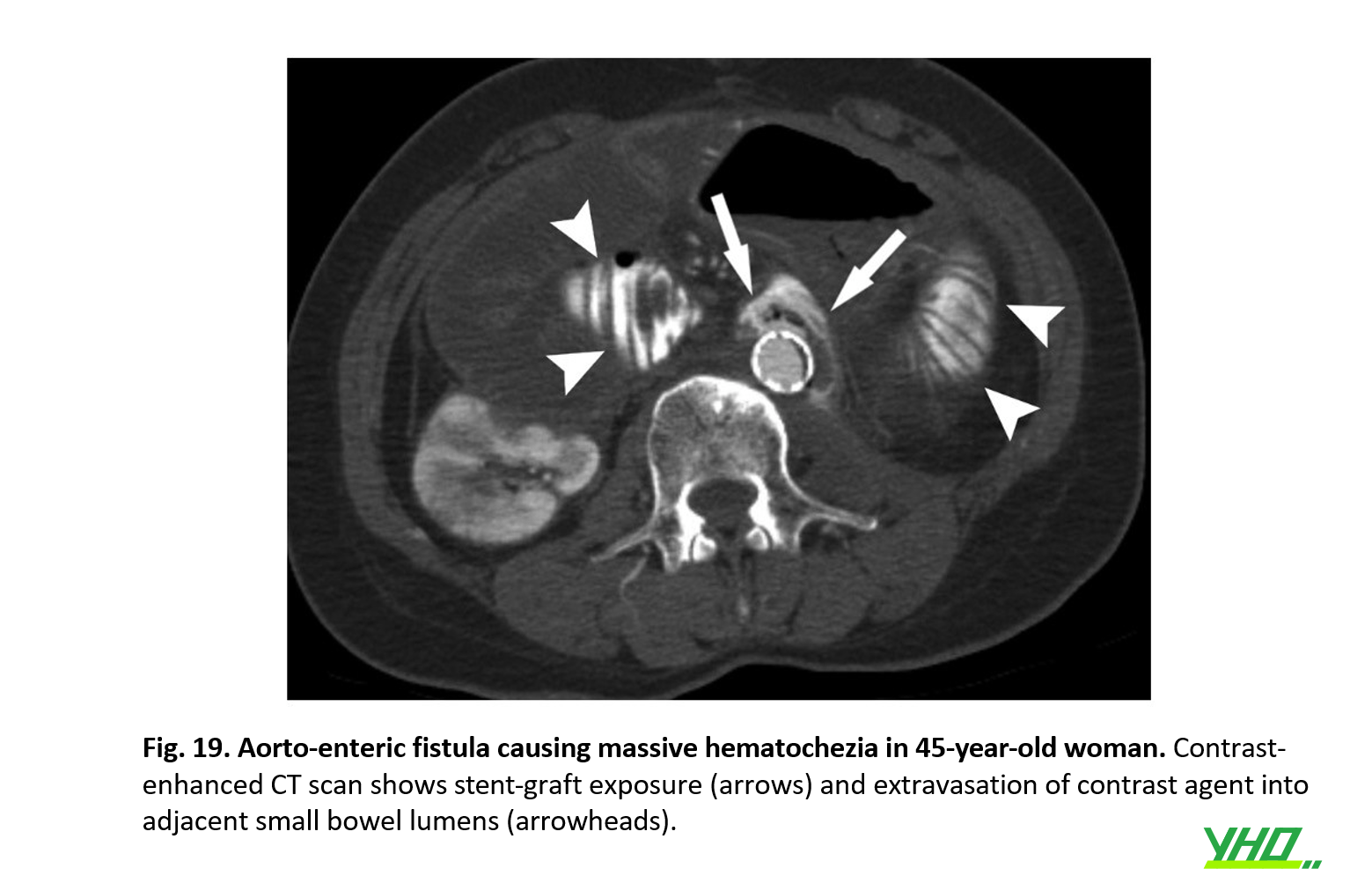
- Chẩn đoán có thể được thực hiện bằng cách kết hợp các kết quả lâm sàng, X quang và xét nghiệm. Sốt, tăng bạch cầu, tụ dịch mủ hoặc thâm nhiễm mô mềm xung quanh stent-graph, sự hiện diện của lỗ rò động mạch chủ-ruột và lòng giả bị nhiễm trùng là những đầu mối chẩn đoán nhiễm trùng stent graft (Hình 18, 19)
- Điều trị phẫu thuật thường được chỉ định cho nhiễm trùng stent-graft, bao gồm loại bỏ stent-graft, cắt bỏ mô bị nhiễm trùng và tái tạo dòng chảy động mạch để bảo tồn dòng chảy xa. Dựa trên tình trạng lâm sàng, có thể sử dụng kháng sinh tĩnh mạch bảo tồn. Thời gian điều trị bằng kháng sinh có thể kéo dài vài tuần, vài tháng hoặc nhiều năm. Đôi khi có thể cần phải điều trị ức chế bằng kháng sinh suốt đời.

KẾT LUẬN
EVAR xâm lấn tối thiểu cho AAA hiện đã trở thành phương pháp điều trị chính cho AAA. Với sự tiến bộ của thiết bị và kỹ thuật nội mạch, các chỉ định về EVAR ngày càng rộng hơn và kết quả lâm sàng ngày càng tốt hơn ngay cả trong AAA phức tạp và các tình huống lâm sàng khác nhau.
Hiểu được tầm quan trọng của đặc điểm giải phẫu của AAA, lập kế hoạch đầy đủ cho từng AAA và thực hiện các thủ thuật phụ trợ thiết yếu đều quan trọng. Kiến thức về đặc điểm của các loại stent-graft khác nhau là rất quan trọng để lựa chọn thiết bị phù hợp nhất nhằm điều trị hoàn toàn AAA.
Những thủ thuật viên sẵn sàng thực hiện EVAR như một phương pháp điều trị cho AAA nên biết về các bước quy trình tổng thể của EVAR và các biến chứng có thể xảy ra sau EVAR. Kiến thức sâu rộng về việc quản lý đầy đủ các biến chứng khác nhau sau EVAR có thể cải thiện kết quả của thủ thuật và làm cho EVAR trở thành một thủ thuật an toàn hơn.
Thoracic Endovascular Aortic Repair (TEVAR) SỬA ĐỘNG MẠCH CHỦ NGỰC NỘI MẠCH
TỔNG QUAN
Năm 1994, Dake lần đầu tiên báo cáo việc sử dụng “stent-grafts” để điều trị phình ĐMC ngực xuống (TAA) ở những BN có nguy cơ cao khi phẫu thuật. Việc đặt stent graft có thể được thực hiện từ quan điểm kỹ thuật với tỷ lệ bệnh tật tương đối thấp. Tuy nhiên cần phải theo dõi BN lâu dài. Các stent ban đầu được chế tạo bởi chính các bác sĩ thực hiện cấy ghép.
Năm 2005, FDA phê duyệt hệ thống stent ghép ngực thương mại đầu tiên trong điều trị TAA, hệ thống Gore TAG.
Năm 2008, FDA phê duyệt hệ thống Cook Zenith TX2 và Medtronic Talent.
Thử nghiệm lâm sàng ngẫu nhiên dẫn đến sự chấp thuận thiết bị TAG cho thấy ở những BN có giải phẫu phù hợp, TEVAR có thể được thực hiện với tỷ lệ tử vong thấp hơn so với phẫu thuật (2,1% so với 11,7%), ít thiếu máu cục bộ tủy sống (3% so với 14%), suy hô hấp (4% so với 20%) và suy thận (1% so với 13%) hơn. Tuy nhiên, TEVAR gây ra nhiều biến chứng ở đường vào mạch máu hơn. Một tỷ lệ nhỏ BN TEVAR không loại hoàn toàn phình mạch sau 1 và 2 năm theo dõi. Do đó tất cả BN trải qua TEVAR đều cần được theo dõi chặt chẽ và lâu dài.
Dake sau đó đã chỉ ra rằng TEVAR khả thi về mặt kỹ thuật ở những BN bị bóc tách ĐMC ngực xuống.
Trong lịch sử, phẫu thuật ở những BN bị tưới máu kém do bóc tách có tỷ lệ tử vong cao.
Nghiên cứu đa trung tâm STABLE ở Hoa Kỳ về TEVAR cho những BN bị bóc tách động mạch chủ týp B phức tạp (cTBAD) được điều trị bằng stent ngực TX2 ở đầu gần và stent kim loại ở đầu xa (Zenith Dissection Endovascular System; Cook Medical, Bloomington, IN). Các tiêu chí chọn bệnh bao gồm:
- 1.Suy giảm tưới máu mạch nhánh
- 2.Dọa vỡ
- 3.Đường kích ĐM chủ ≥40 mm
- 4.Dãn nhanh ĐMC
- 5.Đau dai dẳng hoặc tăng huyết áp dù đã điều trị nội khoa tối đa
Trong thử nghiệm này, tỷ lệ tử vong 30 ngày là 5% (2/40); hai trường hợp tử vong sau 30 ngày, dẫn đến tỷ lệ sống sót sau 1 năm là 90%. Các nhà nghiên cứu ghi nhận có tái cấu trúc ĐMC với giảm đường kính lòng giả, tăng đường kính lòng thật, với huyết khối hoàn toàn lòng giả sau 1 năm là 31%
TEVAR cũng có thể được sử dụng ở những BN bóc tách không biến chứng. Thử nghiệm INSTEAD XL (bệnh nhân bóc tách ĐMC týp B) sau 5 năm cho thấy lợi ích sống còn ở những BN được TEVAR so với điều trị nội khoa (nguy cơ tử vong do ĐMC là 6,9% so với 19,3%), cũng như nguy cơ tiến triển bệnh ít hơn (27,0% so với 46,1%).
Patterson (2013) sử dụng dữ liệu được thu thập từ hơn 1000 TEVAR của Medtronic Thoracic Endovascular Registry (MOTHER), đã thực hiện phân tích phân nhóm các BN trải qua TEVAR để điều trị TAA, bóc tách động mạch chủ týp B mãn tính (CTBAD) và bóc tách cấp ĐMC týp B (ATBAD). TEVAR có tác dụng bảo vệ khỏi tử vong liên quan đến ĐMC, với tỷ lệ tử vong <1%/năm.
Tỷ lệ không bị tử vong do mọi nguyên nhân theo bảng phân tích sống còn trong toàn bộ thời gian theo dõi là 56% ở nhóm TAA, 64% ở nhóm CTBAD và 42% ở nhóm ATBAD. Tỷ lệ tránh khỏi tử vong do động mạch chủ lần lượt là 93%, 96% và 85%.
Hiện tại, có bốn loại stent ĐMC có chỉ định của FDA để sử dụng cho mục đích thương mại ở Hoa Kỳ, mỗi loại có những đặc điểm riêng cần được xem xét khi lập kế hoạch thủ thuật và lựa chọn thiết bị:
- 1.Valiant Navion thoracic stent graft (Medtronic)
- 2.TAG conformable thoracic endoprosthesis (W. L. Gore & Associates)
- 3.Zenith Alpha thoracic device (Cook Medical)
- 4.RelayPlus system (Terumo Aortic, previously Bolton Medical)
TEVAR đã tồn tại được hai thập kỷ và hiện được coi là phương pháp điều trị hàng đầu cho hầu hết các bệnh lý ĐMC ngực xuống (bao gồm phình ĐMC, bóc tách và loét ĐMCxâm lấn), giúp giảm đáng kể bệnh suất và tử suất so với phẫu thuật. Vật liệu được cải tiến, kích thước ống thông chứa stent giảm, khả năng tương thích mạch máu được nâng cao, mảnh ghép thon gọn và nhiều kích cở hơn đã giúp khả năng ứng dụng TEVAR rộng rãi hơn.
CHỈ ĐỊNH
1.Phình ĐMC ngực xuống
Chỉ định chính thức được FDA phê chuẩn cho các stent-graft hiện có trên thị trường ở Hoa Kỳ (W. L. Gore C-TAG, Cook Alpha, Medtronic Valiant và low-profile Navion, và Bolton Relay) là để điều trị tình trạng phình ĐMC xuống có đường kính lớn hơn ít nhất hai lần so với động mạch chủ liền kề. Hơn nữa, phải có đoạn ĐMC (thường là >2 cm) có kích thước bình thường ở hai đầu chỗ phình mạch (được gọi là khu vực đáp (landing-zone)) để stent-graft có thể bám dính (bịt kín) vào thành động mạch chủ và loại bỏ phình mạch.
2.Bóc tách ĐMC ngực xuống phức tạp
TEVAR ngày càng được xem như là phương pháp điều trị tối ưu cho những BN bóc tách ĐMC ngực xuống phức tạp. Kinh nghiệm lâm sàng theo thời gian, sự phát triển liên tục của các thiết bị nội mạch và một số thử nghiệm đa trung tâm đã dẫn đến sự chấp thuận của FDA đối với Medtronic và Gore thoracic stent graft để sử dụng cho bệnh nhân bóc tách cấp tính và mãn tính..
3.Loét xâm lấn cục bộ
Bệnh nhân bị loét xâm lấn khu trú ở ĐMC ngực tạo thành một nhóm riêng biệt trong đó TEVAR có thể có lợi vì những bệnh nhân này có các vùng khu trú của ĐMC ngực bị mất tính toàn vẹn nội mô có thể dẫn đến vỡ ĐMC đe dọa tính mạng. Che phủ vết loét bằng stent-graft có thể được thực hiện với tỷ lệ biến chứng tối thiểu. Tuy nhiên, những BN bị loét xâm lấn thường mắc bệnh mạch máu ngoại biên lan toả, điều này có thể hạn chế khả năng phù hợp với TEVAR.[
4.Chấn thương động mạch chủ
TEVAR có thể cứu sống và hiện nay đã trở thành tiêu chuẩn chăm sóc cho BN chấn thương động mạch chủ ngực dẫn đến rách nội mạc, giả phình động mạch hoặc vỡ rõ ràng.
CHỐNG CHỈ ĐỊNH
1.Đường kính Landing-zone đầu gần/xa vượt ngoài kích thước 18-42 mm (phình mạch hình thoi và túi/loét xâm lấn), 18-44 mm (chấn thương động mạch chủ), or 20-44 mm (bóc tách)
2.Chiều dài cổ ĐMC ở đoạn gần và xa < 20 mm (phình mạch hình thoi và túi/loét xâm lấn, chấn thương động mạch chủ); phần gần nhất của vùng landing-zone bị bóc tách, Huyết khối chu vi lan rộng hoặc vôi hóa thành ĐMC tại các vùng landing-zone; đây là chống chỉ định tương đối với TEVAR và dẫn đến dò nội mạch týp I.
3.Hình thái mạch máu vùng chậu/đùi không phù hợp với kỹ thuật, dung cụ để tiếp cận mạch máu. Tuy nhiên, có thể tạo ống dẫn chậu-đùi hoặc động mạch chủ-đùi để tạo thuận lợi cho TEVAR bệnh lý ĐMC ngực
4.Liên quan đến nhánh bên (ĐM thân tạng, ĐM dưới đòn, ĐM cảnh). Tuy nhiên, những mạch nhánh này thường có thể được bỏ qua để tạo landing-zone gọi là kỹ thuật hybrid, hoặc sử dụng các stent-graft có nhánh thử nghiệm.
5.Những BN bị rối loạn mô liên kết có nhiều khả năng bị thoái hóa mô hơn nữa (ví dụ bệnh Marfan) đã bị loại khỏi các thử nghiệm đối với các thiết bị có sẵn ở Hoa Kỳ (Cook Alpha, C-TAG, Medtronic Valiant, Bolton Relay).
KẾT CỤC
Hong đã phân tích hồi cứu kết quả lâu dài của TEVAR đoạn gần ở 48 bệnh nhân bóc tách động mạch chủ mạn tính Stanford type B (tuổi trung bình, 58,3 ± 10,6 tuổi; 40 nam, 8 nữ).[Bệnh nhân được theo dõi vào lúc 1, 3, 6 và 12 tháng sau khi điều trị và hàng năm sau đó (theo dõi trung bình, 48,7 ± 40 tháng; khoảng 1-120). Những thay đổi từ trạng thái trước phẫu thuật sang trạng thái ở lần theo dõi cuối cùng như sau:
- Mức động mạch chủ xuống. Lòng thật: 19,2 ± 7,01 mm so với 36,9 ± 9,53 mm; lòng giả: 30,47 ± 15,89 so với 19,16 ± 15,33 mm; đường kính tối đa: 49,67 ± 13,96 so với 56,66 ± 14,95 mm
- Mức cơ hoành. Lòng thật: 16,24 ± 5,41 mm so với 24,41 ± 8,04 mm; lòng giả: 12,37 ± 11,49 so với 14,92 ± 12,25 mm; đường kính tối đa: 34 ± 7,81 so với 38,04 ± 7,7 mm
Sau 5 năm, 81% BN không cần tái can thiệp và sau 10 năm, tỷ lệ này là 50,6%. Tỷ lệ sống sót chung sau 10 năm là 83% và tỷ lệ sống sót liên quan đến ĐMC là 92,3%.
CHUẨN BỊ BỆNH NHÂN
GÂY MÊ
Cả gây mê toàn thân và gây tê tủy sống liên tục đều đã được các tác giả sử dụng. Bắt buộc phải có đường truyền tĩnh mạch lớn để truyền dịch, cùng với việc theo dõi huyết áp liên tục.
TMCB tủy sống là biến chứng đáng sợ của TEVAR nên dẫn lưu tuỷ sống thường được sử dụng. Ống dẫn lưu được đặt để dẫn lưu ở áp suất 10 mm Hg (15 cm H2O) trong 24 giờ và tháo ra sau 48 giờ. Người ta có thể dành dẫn lưu tủy sống cho những bệnh nhân được coi là có nguy cơ cao bị TMCB tuỷ sống (ví dụ, những BN được điều trị phủ rộng ĐMC ngực và những người có tiền sử phẫu thuật sửa phình ĐMC bụng trước đó).
Theo dõi thận trọng sự tiến triển của các khiếm khuyết thần kinh trong giai đoạn đầu hậu phẫu. Những khiếm khuyết thần kinh muộn vẫn có thể được phục hồi bằng cách tăng huyết áp hệ thống và dẫn lưu dịch tủy sống.
TƯ THẾ
BN tư thế nằm ngửa. Khi cần tiếp cận ĐM cánh tay, cánh tay được đặt ở góc 90 độ và được chuẩn bị, che phủ trong vùng phẫu thuật.
Điểm tiếp cận ĐM đùi hai bên được chuẩn bị cùng với bụng lên đến mức núm vú
Toàn bộ phẫu trường được bao phủ bởi lớp keo dính tẩm i-ốt.
Theo dõi
Theo thời gian, các vấn đề với stent-graft có thể phát sinh (ví dụ như uốn cong, di chuyển hoặc rò) mà có hoặc không có các triệu chứng. Do đó, việc giám sát thường xuyên suốt đời bằng CT là cần thiết.[Hầu hết các vấn đề gặp phải sau khi sửa chữa có thể được xử lý bằng kỹ thuật nội mạch.
Tái khám nên được thực hiện trong 1 tháng, 6 tháng và 12 tháng kể từ ngày sửa chữa. Chụp CT lặp lại để đánh giá stent-graft và sự tái định dạng của ĐMC xung quanh stent. Sau 12 tháng đầu tiên, việc theo dõi được thực hiện hàng năm. Để đảm bảo kết quả sau thủ thuật BN phải tuân thủ kế hoạch theo dõi đã được hướng dẫn.
Kỹ thuật: Cân nhắc cách tiếp cận
Chìa khóa để thủ thuật TEVAR thành công bắt đầu bằng việc lập kế hoạch tỉ mỉ trước thủ thuật để xác định kích thước chính xác của stent, chiều dài của nó và mối liên hệ của nó với các nhán mạch quan trọng. Có một số phần mềm cho mục đích này ví dụ phần mềm TerraRecon Aquarius để tạo đường trung tâm và thu được các số đo chính xác về khu vực hạ cánh gần và xa để lập kế hoạch trước phẫu thuật.
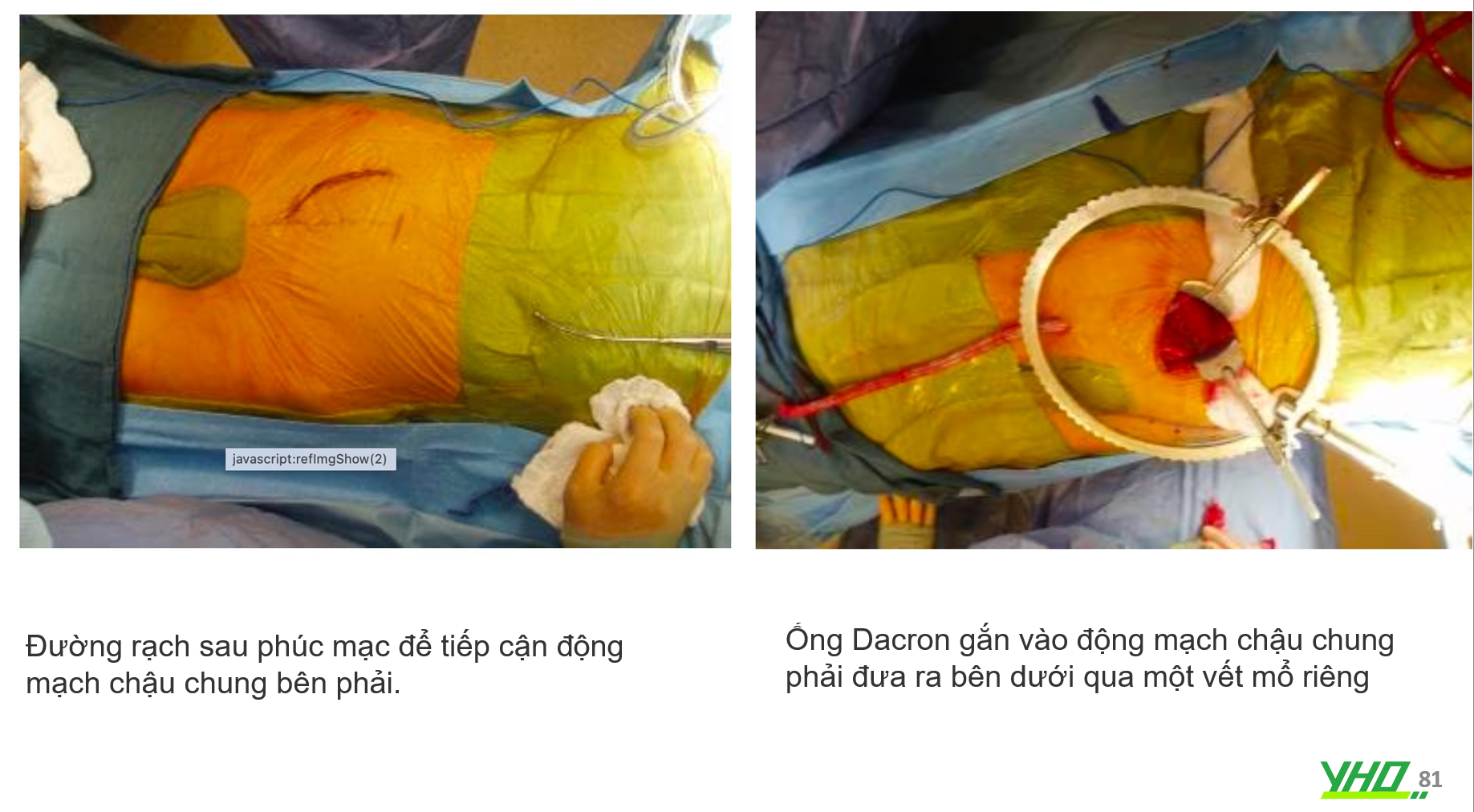
Các vị trí tiếp cận được chọn trên cơ sở giải phẫu được tái tạo bằng chụp CT. ĐM đùi phải có đường kính đủ để cho stent-graft đi qua; nếu không một ống dẫn (ống Dacron 10 mm) phải được gắn vào ĐM chậu thông qua một vết mổ sau phúc mạc.
Cần phải phối hợp chặt chẽ với BS gây mê. Đặt ống dẫn lưu tủy sống cho BN, đặc biệt ở những người có nguy cơ TMCB tuỷ sống cao nhất (Stent-graft ĐMC ngực dài hoặc đã đặt stent graft ĐMC bụng.



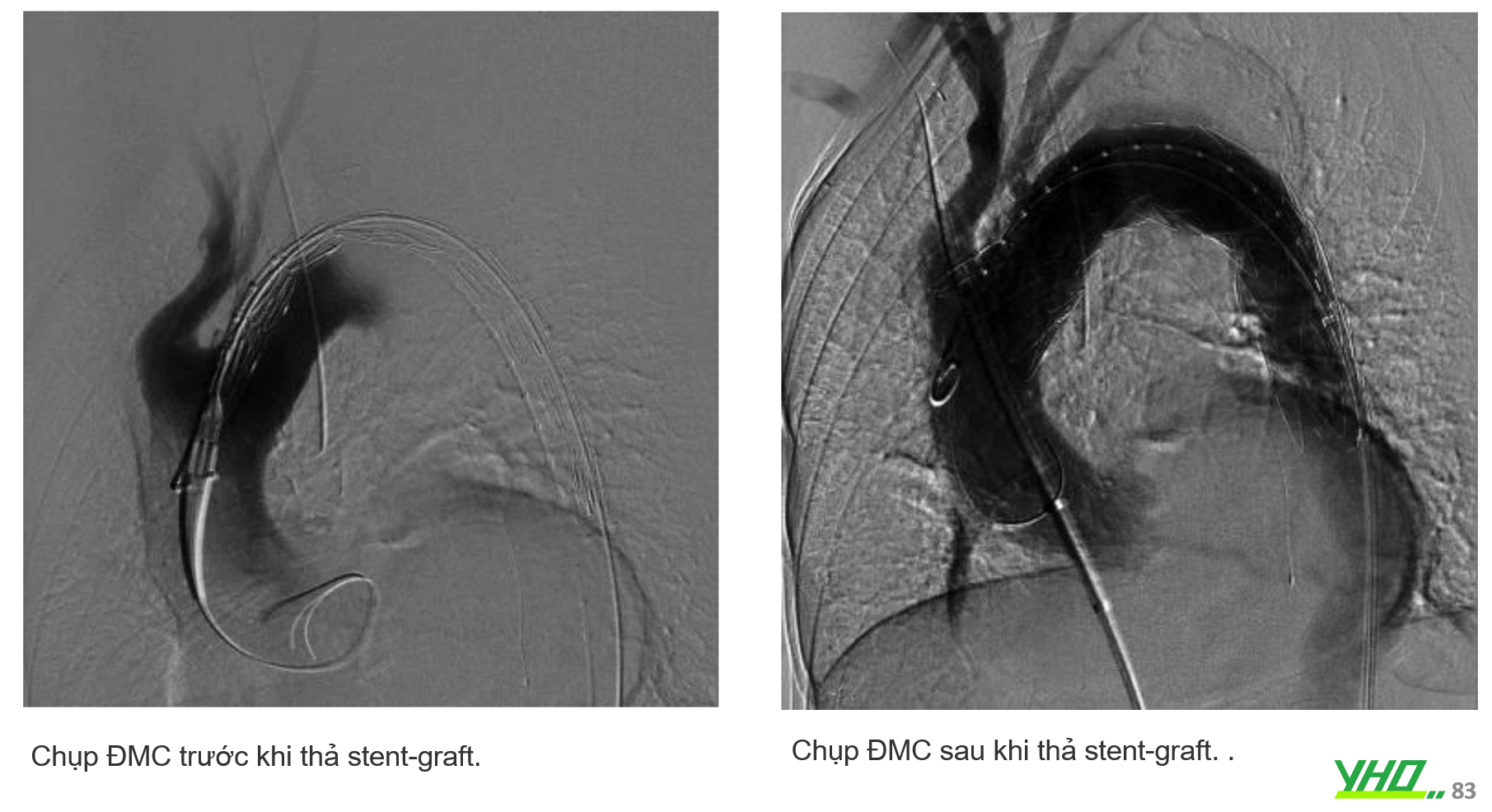
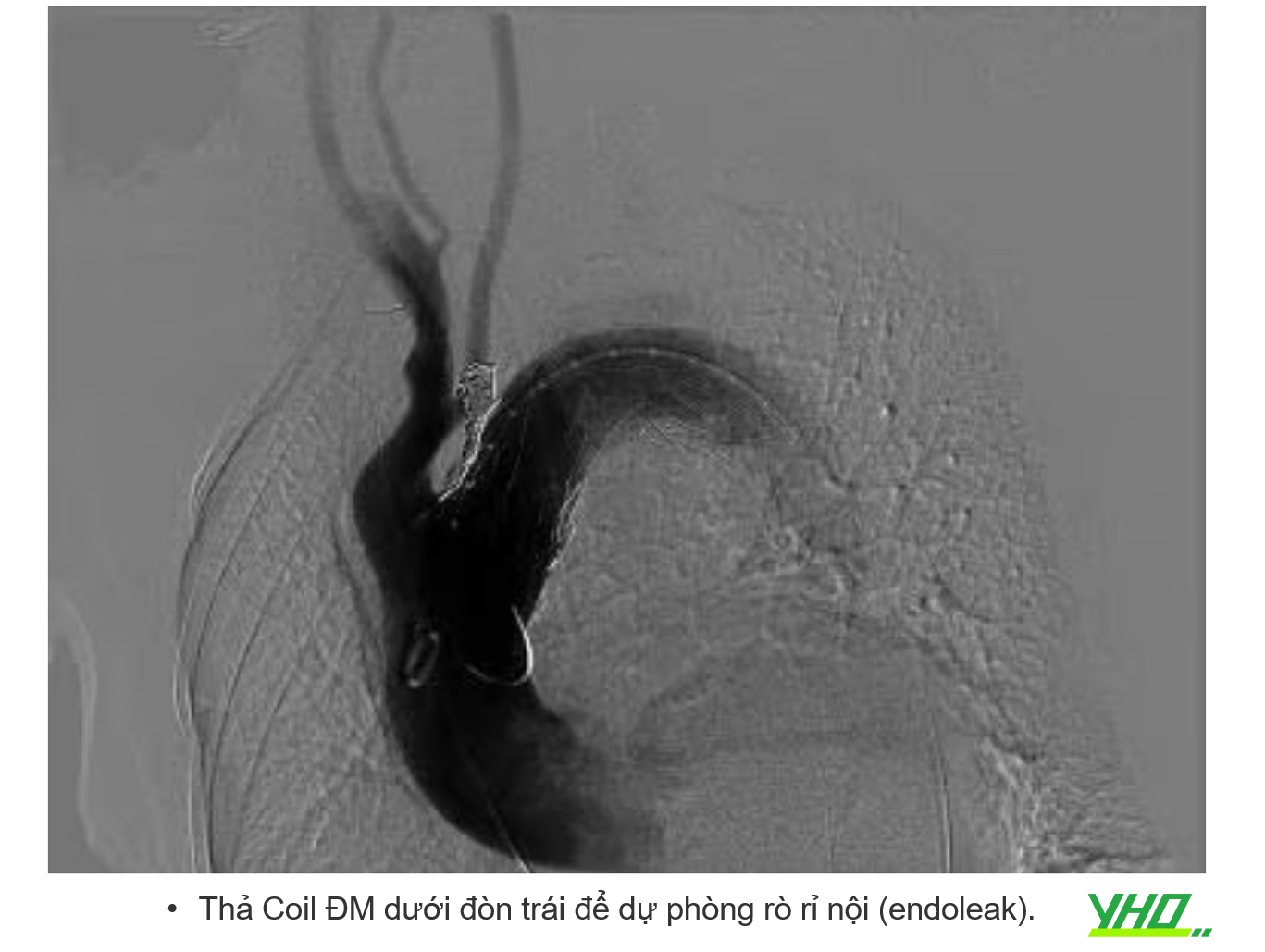
BIẾN CHỨNG
Các biến chứng nghiêm trọng nhất của TEVAR bao gồm:
1.Đột quỵ (4%)
2.Yếu/Liệt 2 chi dưới (2-15%)
3.Tổn thương mạch máu ngoại biên
4.Tử vong
Đột quỵ có thể xảy ra do các dây dẫn được đặt trong cung động mạch chủ để hướng mảnh ghép vào đúng vị trí có thể làm vỡ huyết khối hoặc mảng xơ vữa. thuyên tắc cũng có thể dẫn đến TMCB chi và mạc treo.
TMCB tủy sống (Spinal cord ischemia: SCI) xảy ra khi các mạch máu liên sườn cung cấp máu cho tủy sống bị che bởi mảnh ghép. Một phác đồ để phòng ngừa SCI bao gồm:
1.dẫn lưu dịch não tủy (CSF),
2.Kiểm soát huyết áp (Áp lực động mạch trung bình >90 mm Hg),
3.Bảo đảm thể tích máu (hemoglobin >9 g/dL),
4.Và thuốc hỗ trợ (eg, steroids or naloxone)
được sử dụng rộng rãi ở những BN có nguy cơ cao trước thủ thuật.
Ở những BN có ĐM chậu nhỏ (mạch tiếp cận), việc đặt stent-graft có thể làm tổn thương ĐM đùi và ĐM chậu. Đáng ngại nhất là ĐM bị đứt hoàn toàn. điều này có thể được kiểm soát bằng cách bơm bóng làm tắc mạch. Đây là lý do tại sao phải giữ dây dẫn cho đến khi kết thúc thủ thuật. Mối lo ngại về những tai biến mạch máu nghiêm trọng nhưng hiếm gặp này là một lý do tại sao TEVAR chỉ nên được thực hiện ở các trung tâm có bác sĩ phẫu thuật có kinh nghiệm với kỹ thuật sửa mở.
Rò nôi mạch xảy ra khi phình mạch không được cách ly hoàn toàn khỏi dòng máu. Trong thử nghiệm TAG, những rò như vậy được ghi nhận ở 6% BN sau 1 năm và 9% sau 2 năm. Mặc dù những cải tiến về thiết bị đã giúp giảm đáng kể tỷ lệ rò nội mạch, biến chứng tiềm ẩn này vẫn cần được cân nhắc kỹ lưỡng trong đánh giá giải phẫu của BN và xác định lựa chọn dụng cụ phù hợp cho từng cấu hình giải phẫu riêng lẻ. Điều quan trọng cần nhấn mạnh là BN TEVAR cần được theo dõi suốt đời bằng chụp CT (cuối cùng là hàng năm nhưng ban đầu thường xuyên hơn).
Rò nội mạch được chia thành 4 loại sau
1.Loại I xảy ra khi đóng hai đầu của stent-graft không kín
2.Loại II xảy ra do chảy máu ngược từ các mạch máu nhánh (điển hình là các mạch liên sườn) được che bởi mảnh ghép.
3.Loại III xảy ra khi rò tiến triển giữa các stent ghép chồng lên nhau
4.Loại IV được thấy ở các ống ghép stent trước đây khi độ xốp của vật liệu ghép dẫn đến rò các thành phần máu qua thành ống ghép.