Chụp cắt lớp quang học nội mạch OCT trong đánh giá và hỗ trợ can hiệp mạch vành
LỊCH SỬ VÀ QUÁ TRÌNH PHÁT TRIỂN KỸ THUẬT OCT
Chụp cắt lớp quang học (Optical Coherence Tomography-OCT) đến nay đã trở thành một kỹ thuật ghi hình ảnh sử dụng phổ biến trong quang học y sinh và y khoa. OCT ghi hình chức năng và thể tích khối 3 chiều, cắt ngang có độ phân giải cao các vị cấu trúc trong mô sinh học bằng cách đo và phân tích các tia sáng tán xạ ngược lạ Bệnh học của mô có thể được ghi hình tại chỗ thực tế ảo với độ phân giải 1-15 µm, độ nét biên độ gấp 1- 2 lần so với hình ảnh siêu âm truyền thống. Thực hiện ghi hình bằng một đầu dò sợi quang nhỏ gắn trên ống nội soi kết hợp với ống thông. Với các đặc tính độc đáo trên làm cho OCT trở thành phương tiện hình ảnh mạnh, ứng dụng trong nhiều chuyên khoa cũng như trong nghiên cứu sinh học, khoa học cơ bản và trong nhiều lĩnh vực không y khoa.
OCT là một kỹ thuật hình ảnh y khoa rất mạnh có thể thực hiện “sinh thiết quang học” (“optical biopsy”), cung cấp hình ảnh áo các vị cấu trúc và bệnh học mô tại chỗ, mà không cần phải cắt và xử lý mẫu mô. Mô bệnh học là tiêu chuẩn vàng để chẩn đoán bệnh học nhưng cần phải cắt, cố định, dán, cắt lát mỏng và nhuộm
OCT có thể có nhiều ứng dụng lâm sàng trong nhiều tình huống:
1. Những vị trí mà sinh thiết cắt là nguy hiểm hoặc không thể. Chẳng hạn như các ứng dụng ghi hình võng mạc trong nhãn khoa hoặc động mạch vành trong tim mạch can thiệp.
2. Khi sinh thiết cắt lấy sai mẫu hoặc bỏ sót không lấy được tổn thương. OCT có thể hướng dẫn sinh thiết giúp cải thiện độ nhạy và giảm số mẫu cần lấy. Khi ghi hình ảnh tại chỗ, OCT có thể đánh giá vùng mô lớn hơn sinh thiết cắt. Khi có thể đạt được độ nhạy và độ đặc hiệu đủ trong một số tình huống, OCT có thể sử dụng như chẩn đoán mò học ảo (trong nhãn khoa…).
3. Dùng để hướng dẫn các thủ thuật can thiệp. Khả năng nhìn được cấu trúc 3 chiều và cắt ngang làm cho OCT có khả năng hướng dẫn thủ thuật như đặt stent mạch vành. Trong nhãn khoa, OCT có thể nhìn những thay đổi trong cấu trúc võng mạc và nhận diện các bệnh lý như tân sinh mạch hoặc phù nề, để đánh giá tiến triển hoặc đáp ứng điều trị thuốc. Khả năng thấy được dưới bề mặt mô làm cho nó có thể hướng dẫn các thủ thuật vi phẫu.
4. Dùng để thực hiện đo đạc chức năng và ghi hình. OCT doppler có thể đo đạc định lượng dòng chảy mạch máu. Chụp mạch OCT có thể nhìn thấy vì cấu trúc mô sư dụng chuyển động tương phản tử dòng chảy của máu.
Mặc dù độ sâu ghi hình của OCT bị giới hạn vì hiện tượng giảm dẫn do khuếch tán quang, do hấp thụ hoặc quang sai, khi được nối ghép với dụng cụ y khoa như ống thông, ống nội soi, nội soi ổ bụng hay dụng cụ khẩu, OCT có thể được dùng để đánh giá các cơ quan ống hay rỗng như động mạch vành, ống tiêu hóa hay đường thở cũng như các tạng đặc hay khối. OCT đã trở nên kỹ thuật hình ảnh chuẩn trong nhãn khoa với ước tính khoảng 30 triệu thủ thuật được thực hiện mỗi năm trên toàn thế giới (3,4)
Ghi hình OCT nội mạch cũng dần trở thành một kỹ thuật hình ảnh quan trọng giúp hiểu được sinh học bệnh mạch vành và tối ưu quyết định can thiệp và đặt stent mạch vành. Ứng dụng OCT cũng đang được phát triển trong nhiều chuyên khoa lâm sàng khác như da liễu hoặc dạ dày-ruột, và việc sử dụng nó trong nghiên cứu cơ bản vẫn tiếp tục được mở rộng.
Trong phần này sẽ tổng quan lại lịch sử, sự phát triển ban đầu của OCT từ nghiên cứu ghi hình ngoài cơ thể đến ghi hình tiền lâm sàng trên động vật và cuối cùng đến những nghiên cứu đầu tiên trên bệnh nhân. Chúng tôi giới thiệu tóm lược những phát triển kỹ thuật then chốt làm cho OCT có thể ứng dụng ghi hình ảnh nội nhân cầu và ứng dụng vượt ra ngoài nhãn cầu. Hoạt động thương mại là bước then chốt làm đẩy mạnh OCT đến cộng đồng lâm sàng rộng lớn hơn, nơi các phương pháp mới cuối cùng có thể giúp ích cho bệnh nhân và tác động trên nền kinh tế 3,4
SỰ PHÁT TRIỂN CỦA KỸ THUẬT OCT
Kỹ thuật và hệ thống OCT giai đoạn sớm
Ghi hình OCT được giới thiệu đầu tiên năm 1991 bởi Huang và cộng sự. Khái niệm tương tự cũng được đề xuất độc lập bởi Tanno ở Nhật Bản 1991. Hình 1 cho thấy hình ảnh OCT đầu tiên của võng mạc và động mạch vành ngoài cơ thể với hình ảnh mô học tương ứng. Những ví dụ này minh họa ghi hình OCT trong cả hai chuyên khoa nhãn khoa và mô tim mạch mà hôm nay được ứng dụng nhiều nhất trong lâm sàng.
 Hình 1. Hình ảnh võng mạc và động mạch vành ex vivo với hình mô học tương ứng. Ghi hình thực hiện ở độ phân giải trục 15 µm và chiều dài sóng 830 nm. Hình ảnh OCT được biểu hiện dùng thang màu giả của ánh sáng đến từ 60 to –90 dB (Hình trên trái). OCT biểu hiện được đường viên đầu thần kinh thị và mạch máu. Nhìn thấy được lớp sợi thần kinh võng mạc và bóc tách võng mạc với tích lũy dịch xảy ra sau chết (Hình dưới trái). Hình bên phải là ghi hình OCT của mảng vôi-xơ (3/4 mẫu bên phải) và xơ vữa bên trái (phần mẫu bên trái). Mảng vôi mã khuếch tán ánh sáng làm hạn chế độ xuyên sâu của hình (Huang và cộng sự ).
Hình 1. Hình ảnh võng mạc và động mạch vành ex vivo với hình mô học tương ứng. Ghi hình thực hiện ở độ phân giải trục 15 µm và chiều dài sóng 830 nm. Hình ảnh OCT được biểu hiện dùng thang màu giả của ánh sáng đến từ 60 to –90 dB (Hình trên trái). OCT biểu hiện được đường viên đầu thần kinh thị và mạch máu. Nhìn thấy được lớp sợi thần kinh võng mạc và bóc tách võng mạc với tích lũy dịch xảy ra sau chết (Hình dưới trái). Hình bên phải là ghi hình OCT của mảng vôi-xơ (3/4 mẫu bên phải) và xơ vữa bên trái (phần mẫu bên trái). Mảng vôi mã khuếch tán ánh sáng làm hạn chế độ xuyên sâu của hình (Huang và cộng sự ).Ghi hình được thực hiện với độ phân giải trục 15 µm trong mộ với chiều dài sóng 830 nm. Hình ảnh được biểu hiện dùng thang màu giả với một mức tín hiệu trong dãy từ 60 (màu đỏ) đến 90 dB (màu xanh dương đậm) của cường độ đến. Hình ảnh OCT vòng mạc ở hình 1 cho thầy đường viền của đầu dãy thần kinh thị cũng như mạch máu võng mạc gần đầu thần kinh. Lớp sợi thần kinh võng mạc cũng được nhìn thấy xuất phát từ đầu dây thần kinh thị.
Hình ảnh OCT của động mạch vành trong hình 1 cho thấy mảng xơ – vôi bên phía phải của mẫu và mảng vữa – xơ bên phía trái. Mãng xơ – vôi cùng dễ nhìn thấy vì nó phân tán quang và che (bóng lưng) các cấu trúc phía dưới.
OCT vươn ra khỏi nhãn khoa đến ghi hình ảnh trong nội mạch và trong nội soi
Độ nhạy phát hiện và đặc tính quang học mô là đặc biệt quan trọng trong ghi hình vì các tín hiệu quang bị phân tán và giảm dần do phân tán, hấp thụ hoặc quang sai. Trong mắt, con đường từ giác mạc đến võng mạc (qua dịch mắt, thủy tinh thể, dịch kinh) được dẫn truyền cao, sự tán xạ ngược rất yếu. Ghi hình OCT trong nhãn khoa ban đầu sử dụng ánh sáng chiều dài sóng 800 nm vi hấp thụ nhãn cầu và dịch kín tối thiểu ở chiều dài sóng này. Ghi hình OCT dùng chiều dài sóng dài hơn là bước tiến quan trọng trong các chuyên khoa lâm sàng khác vì làm giảm độ phân tán quang và gia tăng độ xuyên thấu ghi hình. Ở chiều dài sóng ngắn hơn 1100 nm, hấp thụ chủ yếu hầu hết ở melanin và hemoglobin, mà hấp thụ ở chiều dài sóng gần hồng ngoại. Hấp thu nước có đỉnh ở 1430 nm và rất cao khi chiều dài sông dài hơn 1900 nm. Trong hầu hết mô, sự khuếch tán ở chiều dài sóng gần hồng ngoại là 10-20 dB cao hơn hấp thu và sự phân tán sẽ giảm chiều dài sóng dài hơn. Do đó ghi hình ở 1300 nm trở nên là chiều dài sóng chuẩn trong hầu hết các ứng dụng của OCT trong các chuyên khoa lâm sàng khác ngoài nhãn khoa.
 Hình 2. Ghi hình OCT giai đoạn sớm một mảng xơ vữa ex vivo văn hình ảnh môn học tương ứng. Mảng xơ vữa bị vôi hóa cao với nồng độ lipid thấp và một lớp vỏ mỏng. Kết quả này minh họa cho việc OCT có thể ghi nhận được các đặc tính hình thái học gặp ở mảng xơ vữa không ổn định. Scale = 500 µm (Brezinski vȧ cs)
Hình 2. Ghi hình OCT giai đoạn sớm một mảng xơ vữa ex vivo văn hình ảnh môn học tương ứng. Mảng xơ vữa bị vôi hóa cao với nồng độ lipid thấp và một lớp vỏ mỏng. Kết quả này minh họa cho việc OCT có thể ghi nhận được các đặc tính hình thái học gặp ở mảng xơ vữa không ổn định. Scale = 500 µm (Brezinski vȧ cs)Ý tưởng sử dụng OCT đánh giá mảng xơ vữa không ổn định lần đầu tiên được Brez- inski và cộng sự đề nghị năm 1995. Hình 2 giới thiệu hình ảnh OCT đầu tiên của mảng xơ vữa cx vivo và hình mô học tương ứng của Brezinski và công sự năm 1996. Hình ảnh OCT có độ phân giải trục ~15 km trong mở và ghi hình ở chiều dài sóng 1300 nm để tối ưu độ sâu ghi hình. Hình ảnh cho thấy một mảng xơ vữa không ổn định rõ rệt đặc trung bởi lớp vỏ áo trong mỏng kế bên một mảng vôi hóa nặng với thành phần lipid thấp. Minh họa này cho thấy OCT có thể biểu hiện đặc tính của mảng xơ vữa trong mẫu ex vivo. Đây là cột mốc quan trọng giúp sự phát triển ghi hình OCT vào trong kỹ thuật, làm sáng và thương mại.
Ghi hình OCT nội mạch ban đầu
Sự phát triển OCT nội mạch khá là thách thức khó khăn vì đòi hỏi kỹ thuật ghi hình, thiết bị y khoa, các nghiên cứu ex vivo, các nghiên cứu tiền lâm sàng và nghiên cứu lâm sàng kết hợp với các vấn đề về quy định luật lệ và chi trả phức tạp. Hình 3 cho thấy hình ảnh động mạch vành con người đầu tiên ex vivo, sử dụng ống thông OCT 2.9 F dạng ban đầu của Tearney và cộng sự năm 1996, Hình ảnh so sánh giữa OCT với IVUS 30 MHz. Sự phân biệt giữa các lớp áo trong, áo giữa và áo ngoài rất rõ ràng cho thấy những ưu điểm vượt trội của OCT nội mạch.
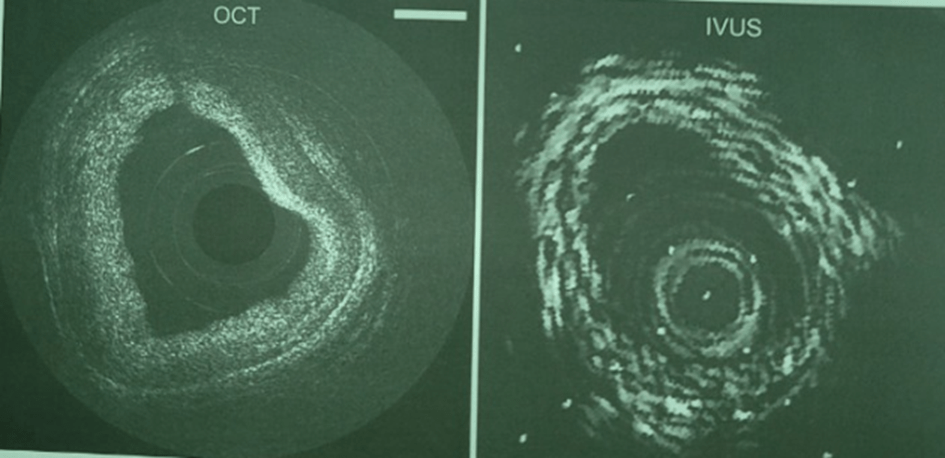 Hình 3. Ghi hình OCT động mạch vành người ex vivo giai đoạn đầu và so sánh với hình ảnh IVUS. OCT có độ phân giải trục 15 µm và có thể phân biệt rõ lớp áo trong, áo giữa và áo ngoài. Cũng ghi nhận có tăng sản lớp áo trong (Teurney và cs ).
Hình 3. Ghi hình OCT động mạch vành người ex vivo giai đoạn đầu và so sánh với hình ảnh IVUS. OCT có độ phân giải trục 15 µm và có thể phân biệt rõ lớp áo trong, áo giữa và áo ngoài. Cũng ghi nhận có tăng sản lớp áo trong (Teurney và cs ).CÁC NGHIÊN CỨU ĐỂ PHÁT TRIỂN KỸ THUẬT OCT
Các nghiên cứu tiền lâm sàng
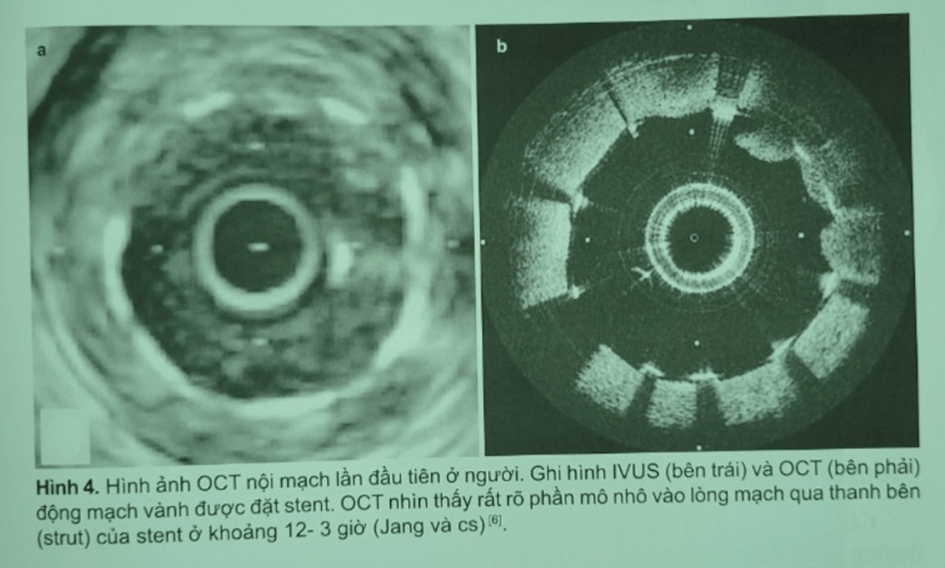
Để thực hiện ghi hình OCT trên cơ thể sống cần phải phát triển các hệ thống ống thông cải tiến hơn có thể dùng trên động vật và người. Hơn nữa, máu làm khuếch tán và làm giảm dần ánh sáng nên cần phát triển các kỹ thuật đuổi máu hay pha loãng máu. Fujimoto và cộng sự thực hiện ghi OCT trên thọ năm 1999 sử dụng nước muối pha loãng máu. Tearney và cộng sự thực hiện trên lợn năm 2000 so sánh OCT với IVUS và đuổi máu bằng nước muối. Nghiên cứu đã cho thấy hình ảnh của OCT tốt hơn IVUS trong đánh giá cấu trúc mạch vành, bóc tách và áp sát thành của stent (Hình 4).
Các nghiên cứu xác định giá trị mô học
Cùng với việc thực hiện các nghiên cứu khả thi ứng dụng kỹ thuật vào lâm sàng, việc xác định đặc tính hình ảnh OCT và ý nghĩa lâm sàng là cũng quan trọng không kém. Bước đầu tiên là xác lập tương quan giữa hình ảnh OCT với mô bệnh học. Các nghiên cứu ở giai đoạn sớm của Brezinski cho thấy OCT rất tốt đối với mảng xơ vữa lớp vỏ mỏng và các dạng khác của mảng xơ vữa như xơ, mỡ và đặc biệt vôi hóa (Hình 5), Nghiên cứu của Yabushita và cs năm 2002 khá toàn diện. Nghiên cứu cho thấy độ nhạy (71-97%) và độ đặc hiệu rất cao (90-98%), đặc biệt với mảng xơ – vôi. Do đó, OCT đánh giá mảng xơ vữa có độ nhạy và độ đặc hiệu cao so với mô bệnh học.
Các nghiên cứu lâm sàng và các tiến bộ về trang thiết bị phục vụ OCT
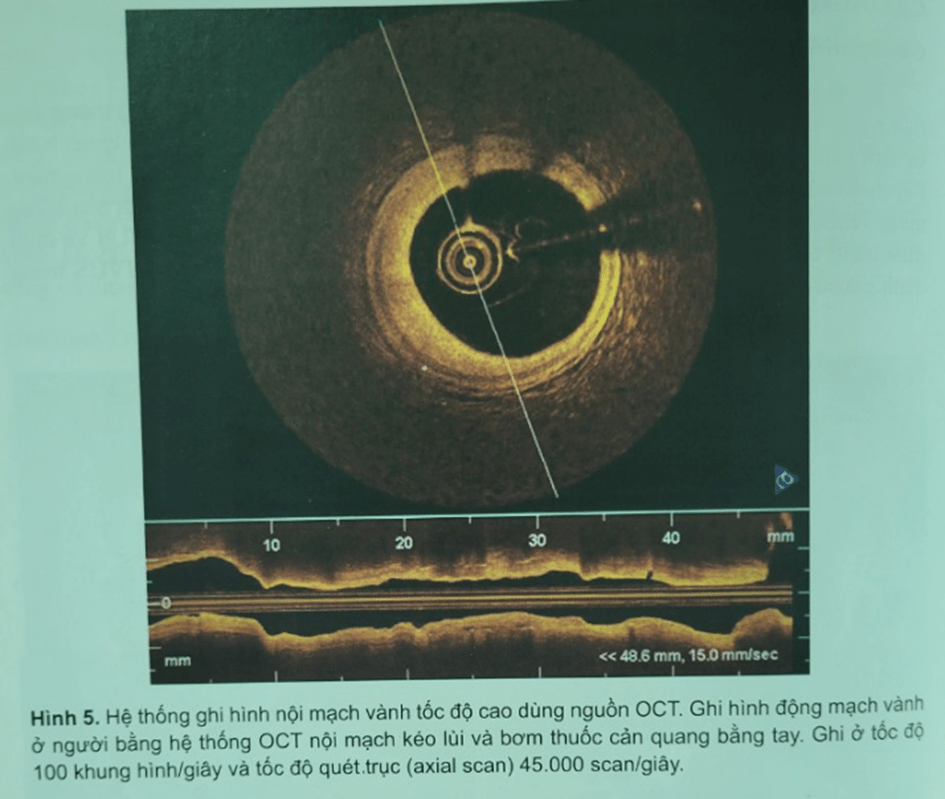
Các nghiên cứu lâm sàng đều tập trung vào việc đánh giá các tổn thương hay bất thường mạch vành đồng thời so sánh với IVUS, là tiêu chuẩn vàng của hình ảnh cấu trúc và tổn thương mạch vành. Nghiên cứu đầu tiên của Jang và cộng sự năm 2001, sau đó của Grube và cộng sự năm 2002, rồi nhiều nghiên cứu sau đó. Tất cả các nghiên cứu đều chủ thấy rằng tất cả những tổn thương được IVUS phát hiện như các mảng xơ, vôi hóa, các vùng phản âm trống đều được OCT nhận diện và một số tổn thương như dày lớp áo trong hoặc lắng đọng mỡ trong thành còn được OCT phát hiện tốt hơn IVUS.
Để tiếp tục phát triển OCT đưa vào thương mại và thực hành lâm sàng, các thử nghiệm lâm sàng đa trung tâm bắt đầu được tiến hành và liên tục có những cải tiến về dụng cụ – trang thiết bị OCT (Hình 6, Hình 7, Hình 8).
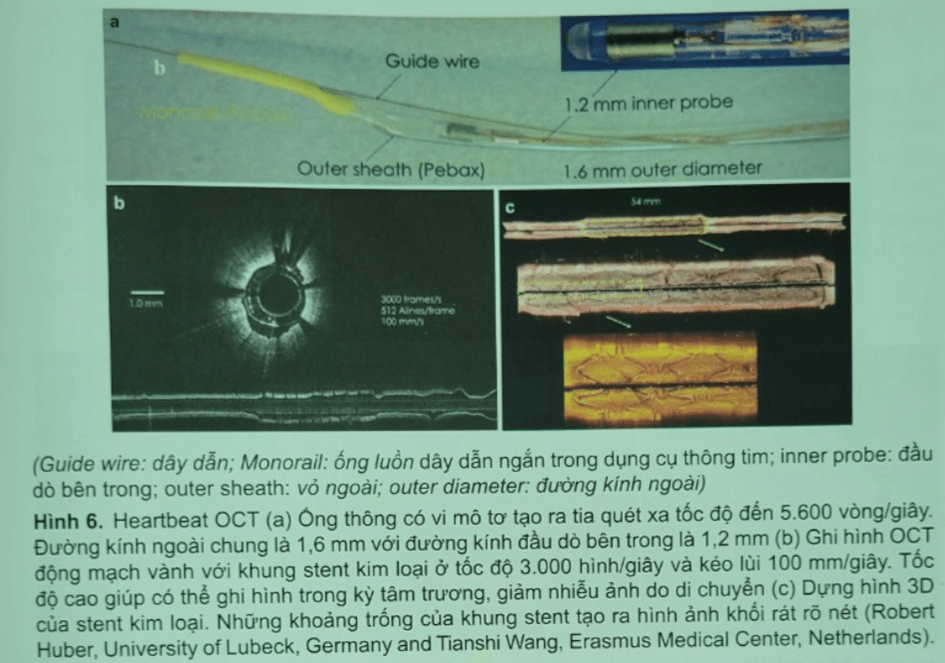
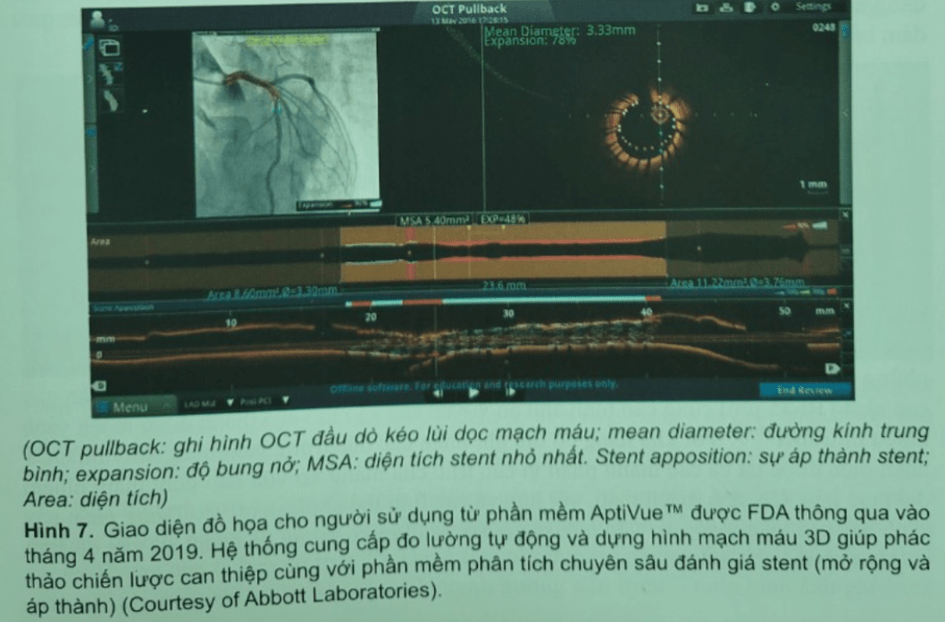
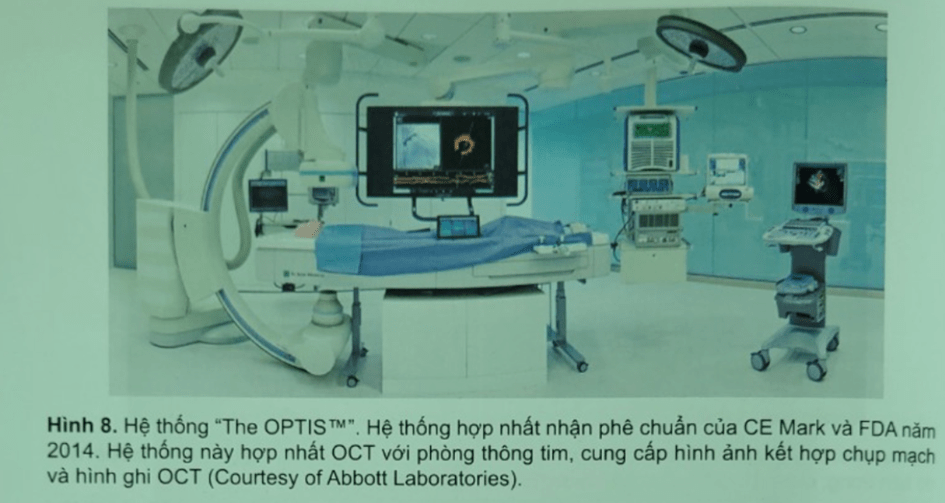
TÓM LƯỢC VỀ SỰ PHÁT TRIỂN KỸ THUẬT HÌNH ẢNH OCT
OCT là một kỹ thuật hình ảnh rất mạnh trong nghiên cứu y sinh học và trong y khoa vì nó có thể quan sát tại chỗ với độ phân giải cao, tốc độ cao các cấu trúc mô, chức năng và bệnh học, mà thường không thể có bằng các phương pháp khác. Nhiều bài báo đã được đăng trong các tạp chí về OCT trong các năm qua. Các tạp chí khoa học là các chứng cứ đảm bảo tính khoa học của kỹ thuật này.
CÁC KIỂU MẢNG XƠ VỮA ĐỘNG MẠCH VÀNH
Bệnh động mạch vành do xơ vữa tuy có nhiều tiến bộ trong dự phòng, chẩn đoán và điều trị nhưng vẫn là một trong các nguyên nhân tim mạch hàng đầu trong bệnh suất và tử suất. Các nghiên cứu bệnh học cung cấp nhiều thông tin về sinh lý bệnh của bệnh động mạch vành. Tuy nhiên trong thập niên vừa qua, các nhà khoa học đã tập trung sự chú ý trên các phương thức ghi hình ảnh động mạch vành và mảng xơ vữa trong cơ thể nhằm tìm ra các đặc trưng sinh bệnh học nền tảng của các biểu hiện lâm sàng với mục tiêu cuối cùng là cá thể hóa chiến lược điều trị và cải thiện tiên lượng cho bệnh nhân. Trong những kỹ thuật này, OCT là một kỹ thuật dựa trên sự giao thoa ánh sáng có độ phân giải cao nhất (10-15 µm) cung cấp hình ảnh ảo xuyên sâu vào mô của thành động mạch vành nhiều mili-mét. Với khả năng có thể ghi nhận các đặc trưng của mảng xơ vữa, OCT nhận diện được tất cả các thành phần vi cấu trúc của mảng xơ vữa bao gồm thâm nhiễm đại thực bào, tân sinh mạch máu, vôi hóa và các tinh thể cholesteroll. Trong phần này trình bày các kiểu mảng xơ vữa mỡ, mảng xơ vữa lớp vỏ mỏng và mảng xơ vữa đã lành và các tỉnh thể cholesterol.
ĐỘNG MẠCH VÀNH BÌNH THƯỜNG VÀ MẢNG XƠ CỦA THÀNH ĐỘNG MẠCH VANH
Ba thành tố cấu thành vách động mạch vành bình thường gồm lớp áo trong (tế bào biểu mô và sợi collagen), lớp áo giữa (tế bào cơ trơn và sợi đàn hồi) và lớp áo ngoài (sợi collagen), có thể nhìn thấy bằng OCT với độ rõ ràng và chính xác cao nhờ khả năng phân giải không gian. Áo trong là lớp có tín hiệu sáng lót quanh bề mặt lòng mạch máu. Áo giữa là lớp nằm ở giữa kém tín hiệu màu tối đồng nhất vì ít sợi collagen và nhiều tế bào cơ trơn và chất ngoại bào. Áo ngoài là lớp giàu tín hiệu bao quanh bên ngoài (Hình 9).
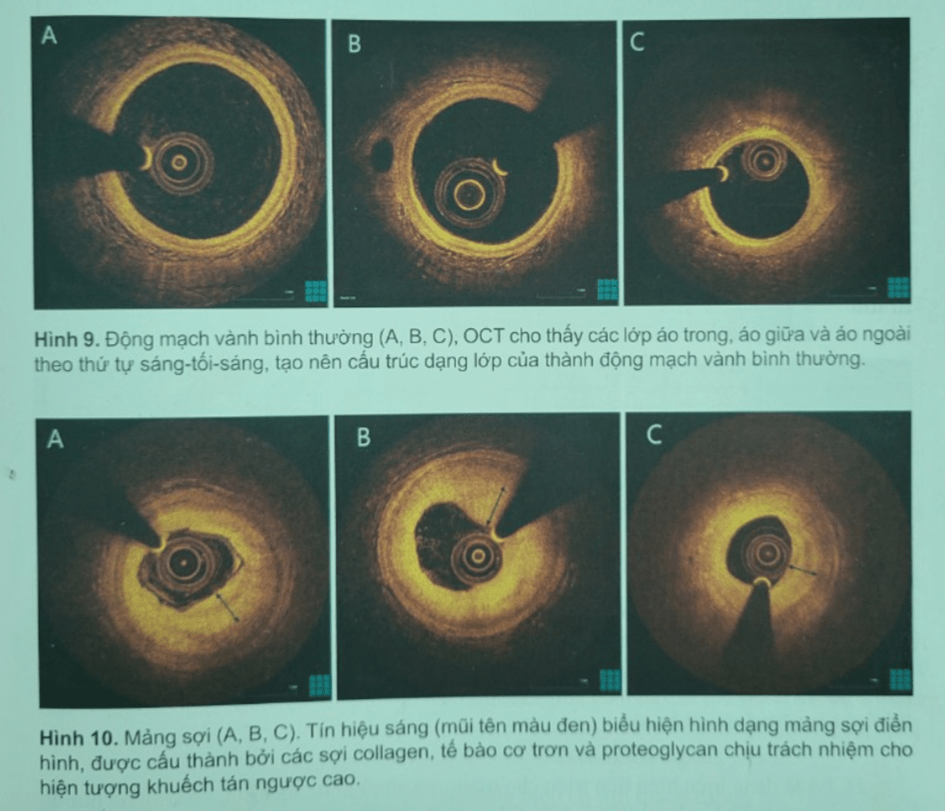 Hình 10. Mảng sợi (A, B, C). Tín hiệu sáng (mũi tên màu đen) biểu hiện hình dạng mảng sợi điển hình, được cấu thành bởi các sợi collagen, tế bào cơ trơn và proteoglycan chịu trách nhiệm cho hiện tượng khuếch tán ngược cao.
Hình 10. Mảng sợi (A, B, C). Tín hiệu sáng (mũi tên màu đen) biểu hiện hình dạng mảng sợi điển hình, được cấu thành bởi các sợi collagen, tế bào cơ trơn và proteoglycan chịu trách nhiệm cho hiện tượng khuếch tán ngược cao.Tổn thương xơ vữa ban đầu trên mô học gồm các “vệt mờ” ở lớp áo trong, là các tế bảo bọt bị thực bào xâm nhiễm vào lớp áo trong và tích tụ khu trú chất nền ngoại bào giàu proteoglycan của tế bào cơ trơn. Dạng tiền tổn thương này có thể thoái hóa theo thời gian nhất là ở người trẻ và không có khuynh hưởng tiến triển. Trong hình ảnh ghi bằng OCT, các tổn thương ban đầu xuất hiện dưới dạng dày lớp áo trong với tán xạ ngược cao, biểu hiện bằng giảm quang. Dạng tổn thương này có tương quan với hiện diện đại thực bào chứa các tế bào bọt trong mô học. Gia tăng số lượng tế bào cơ trơn tích lũy trong chất nền giàu collagen và proteoglycan gặp ở tổn thương sớm, ngay sát lớp áo giữa và dày lớp áo trong đặc trưng cho bệnh học và không đảo ngược được. Hình ảnh OCT giai đoạn xơ vữa này cho thấy dày khu trú với tán xạ ngược cao và giảm quang nhẹ của những vùng sâu bên dướ. Khi có đại thực bảo xâm lấn vào lớp nông, các vùng lốm đốm sáng tụ lại hoặc tách biệt có tín hiệu sáng với bóng lưng che các cấu trúc phía dưới. Với sự tiến triển của tổn thương xơ vữa và xâm lấn đại thực bảo vào các hồ lipid, kích hoạt nhiều men hủy protein (chủ yếu hoạt hóa các men metalloproteinase và peptidase của họ ADAMTS) góp phần gây thoái giáng hyaluronan và proteoglycan làm cho lõi hoại tử vô bào đặc trưng cho “mảng xơ sợi” (Hình 10).
OCT có khả năng nhận diện được mảng xơ sợi trong các giai đoạn khác nhau bằng các tín hiệu tán xạ ngược cao ở bề mặt và có giảm quang nhẹ ở phần sâu của các hồ lipid và/hoặc thứ phát khi có đại thực bào hay vội hóa. Do tính xuyên thấu mô kém. OCT không thể ghi rõ mảng xơ vữa khi có hoại tử. Tuy nhiên, OCT rất giá trị để đo chiều dày lớp vỏ xơ trên mảng xơ sợi. Lớp vỏ sợi được cấu thành bởi collagen týp 1 và 3 và proteoglycan và tế bào cơ trơn. Lớp vỏ sợi được xác định là “mỏng” theo đồng thuận chung là nếu chiều dày < 65 um. Mảng xơ sợi lớp vỏ mỏng (Thin Cap Fibroatheroma – TCFA) được xác định bằng sự hiện diện của lớp vỏ mỏng và lõi hoại tử lớn (Hình 11, Hình 13).
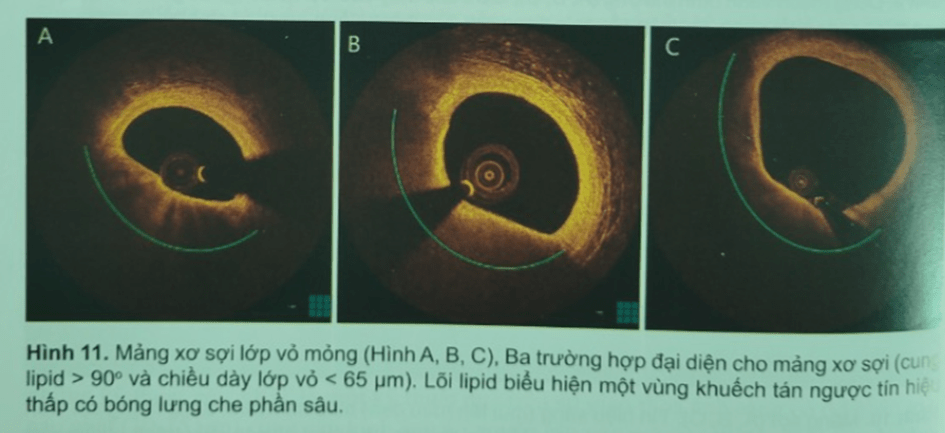 Hình 11. Mảng xơ sợi lớp vỏ mỏng (Hình A, B, C), Ba trường hợp đại diện cho mảng xơ sợi (cung lipid > 90 và chiều dày lớp vỏ < 65 um). Lõi lipid biểu hiện một vùng khuếch tán ngược tín hiệu thấp có bóng lưng cho phần sâu
Hình 11. Mảng xơ sợi lớp vỏ mỏng (Hình A, B, C), Ba trường hợp đại diện cho mảng xơ sợi (cung lipid > 90 và chiều dày lớp vỏ < 65 um). Lõi lipid biểu hiện một vùng khuếch tán ngược tín hiệu thấp có bóng lưng cho phần sâuTCFA là dạng biểu hiện tiền triệu cho mảng xơ vữa không ổn định, có khuynh hướ vỡ và tạo huyết khối cấp (Hình 12). Các nghiên cứu về OCT ghi nhận TCFA thường gặp trong bệnh cảnh mạch vành cấp hơn là mạn và thường nằm ở đoạn gần động mạnh vành. Trong các mảnh xơ vữa bị nứt vỡ, chiều dày trung bình lớp vỏ mỏng nhất là 54 µm và trong phần lớn trường hợp là <80 µm
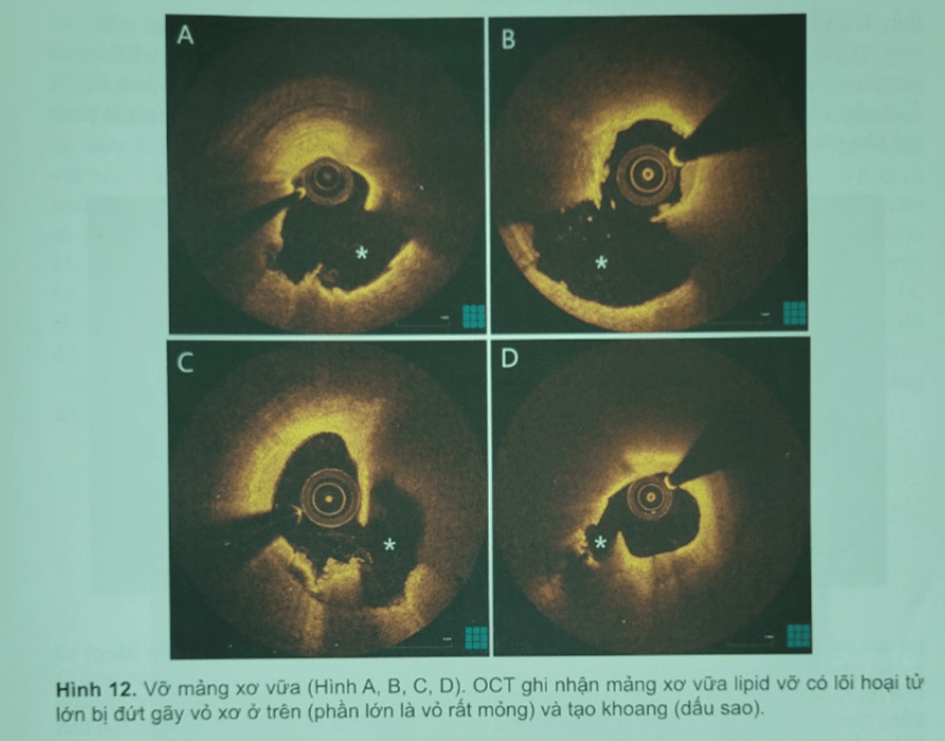
Kích hoạt tiểu cầu và viêm đóng vai trò then chốt trong cơ chế dẫn đến làm mỏng lớp vỏ sợi. Thoái giáng chất nền ngoại bảo được kích hoạt bởi men hủy protein tiết ra từ đại thực bào và các tế bào viêm khác và không được đối trọng bằng cơ chế sửa chữa tế bào đúng mức
Từ quan điểm của điều trị, làm gia tăng chiều dày lớp vỏ sợi rất quan trọng để cải thiện tính ổn định và làm giảm nguy cơ vỡ mảng xơ vữa. Với mục đích này, nhiều nghiên cứu đánh giá vai trò statin với tác động nhiều cơ chế trên máng xơ vữa và đạt được kết quả tốt (gia tăng chiều dày của vỏ sợi và giảm ý nghĩa tỷ lệ lipid). Đáp ứng của mạch máu với statin không bị ảnh hưởng của đái tháo đường nhưng bị giảm khi suy thận. Trong nghiên cứu gần đây của nhóm Akasaka, việc điều trị sớm pitavastin cho bệnh nhân hội chứng mạch vành cấp sẽ hiệu quả giúp tăng tính ổn định các tổn thương không thủ phạm.
TCFA được xem như yếu tố tiên đoàn của biển cố tim mạch tương lai. Trong nghiên cứu PROSPECT, TFCA được xác nhận là mảng xơ vữa không thủ phạm nguy cơ cao nhất có MACE 3 năm cao. Tuy nhiên giá trị tiên đóan thấp. Tương tự trong nghiên cứu sổ bộ CLIMA, TCFA với cung lipid rộng và có thâm nhiễm đại thực bào nhận diện những bệnh nhân có kết cục xấu sau một năm theo dõi. Hơn nữa, các dữ liệu từ các nghiên cứu cho thấy khi kết hợp các đặc tính OCT nguy cơ cao của tổn thương thủ phạm (vỡ mảng xơ vữa, TCFA, xâm nhiễm đại thực bảo và tổn thương nhiều chỗ) với nồng độ CRP huyết thanh cao là yếu tố tiên đoán cho tái phát hội chứng mạch vành cấp sau 3 năm theo dõi. Tuy vậy, vẫn cần thêm những nghiên cứu nữa khẳng định kết quả này và sau cùng là đánh giá khả năng điều trị thuốc chống viêm nhóm bệnh nhân đặc biệt này.
MẢNG XƠ VỮA ĐÃ LÀNH
Mảng xơ vữa đã lành là kết quả của biển có huyết khối trước đó xảy ra thầm lặng đặc biệt là khi gánh nặng mảng xơ vữa thấp và huyết khối nhỏ. Quá trình sửa chữa xảy ra sau giúp ổn định vị trí nứt vỡ hoặc xói mòn tạo thành mảng xơ vữa lành, biểu hiện là các lớp huyết khối đã tổ chức hóa và hoặc collagen riêng biệt. Trong quá trình sửa chữa, collagen typ 3 được thay thế dẫn bằng collagen typ 1, biểu hiện bằng những đài tín hiệu tán quang ngược trên OCT
Các nghiên cứu tử thiết cho thấy các mảng xơ vữa đã lãnh thưởng gặp ở nam giới tử vong vì biến cố mạch vành với tỷ lệ lên đến 61-73% trên toàn bộ cây mạch vành. Ở cuối quá trình lành bệnh, bề mặt được tái biểu mô hóa hoàn toàn và mảng xơ vữa gồm các tế bào cơ trơn và chất nền ngoại bào giàu proteoglycan với một tỷ lệ thành phần lipit tương đối. Khi có hiện diện nhiều lớp mô sợi và lối hoại tử biểu hiện của các lần biến cố huyết khối đã lãnh góp phần gia tăng gánh nặng xơ vữa, lòng mạch máu hẹp dần do cơ chế bù trừ tái định dạng dương tính thất bại vì mô bệnh lý động mạch quá nặng.
Một nghiên cứu thực hiện OCT lập lại để đánh giá sự tiến triển mảng xơ vữa ở bệnh nhân mạch vành mạn, cho thấy 20% tổn thương không thủ phạm phát triển theo thời gian biểu hiện bằng các mảng xơ vữa lành. Nghiên cứu đầu tiên xác định giá trị chẩn đoán OCT bằng mô học đã mô tả hình ảnh mảng xơ vữa đã lành với đặc trưng nhiều lớp mô có độ sáng khác nhau nằm phía trên lõi hoại tử lớn, có thể kèm theo hay không hiện tượng vôi hóa. Cho đến gần đây, một nghiên cứu bệnh học đã làm rõ liên quan giữa mô học và hình ảnh OCT quan sát in vivo của các mảng xơ vữa đã lãnh . Nổi bật là nghiên cứu của nhóm Akasaka khảo sát 144 hình ảnh cắt ngang mạch máu với mảng xơ vữa hẹp trên 50% khi ghi hình OCT, thực hiện cùng với mô học. Mảng xơ vữa đã lành nhận diện được trên OCT là màng có nhiều lớp tín hiệu sáng không đồng nhất với độ sáng khác nhau (Hình 14, Hình 15). Người ta nhận thấy giá trị tiên đoàn âm tính, giá trị tiên đoán dương, độ nhạy, độ đặc hiệu rất cao của sự tương quan với mô học . Thêm nữa, các thành phần và vị cấu trúc của vi mạch đặc biệt và đại thực bào có thể nhận thấy mảng xơ vữa đã lành và các mảng không có lớp.
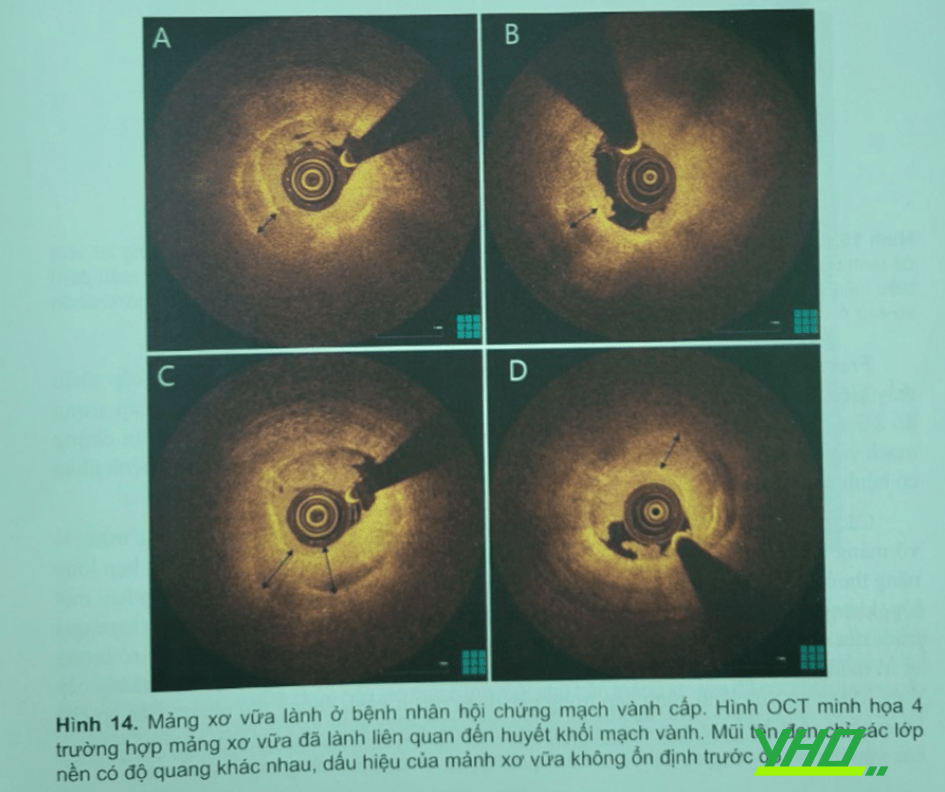
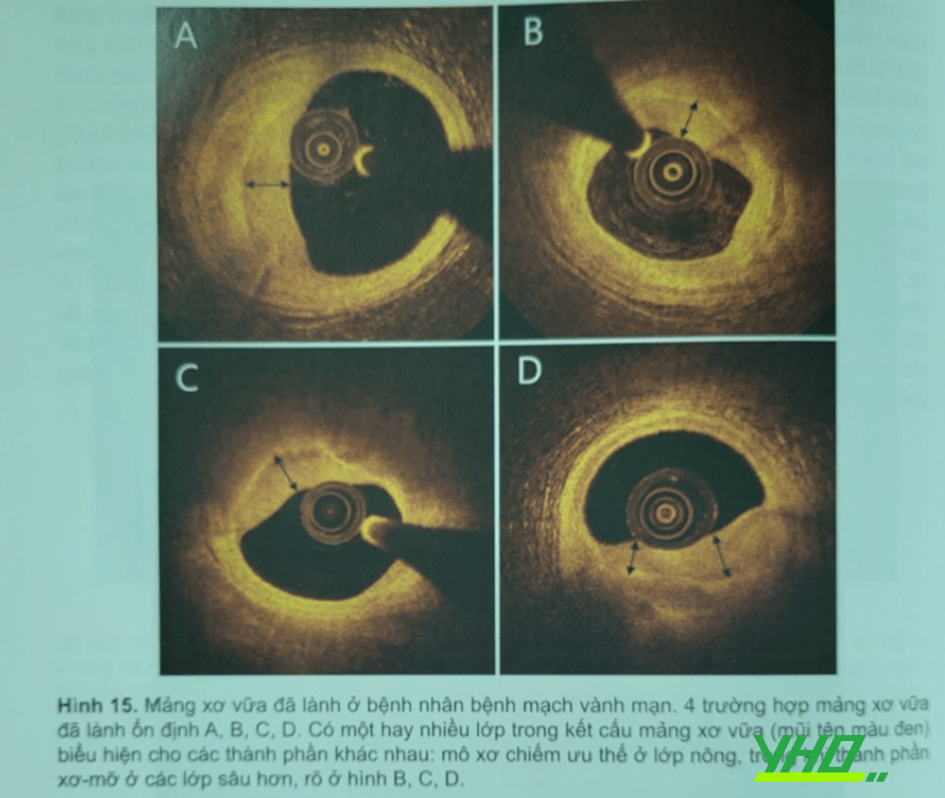
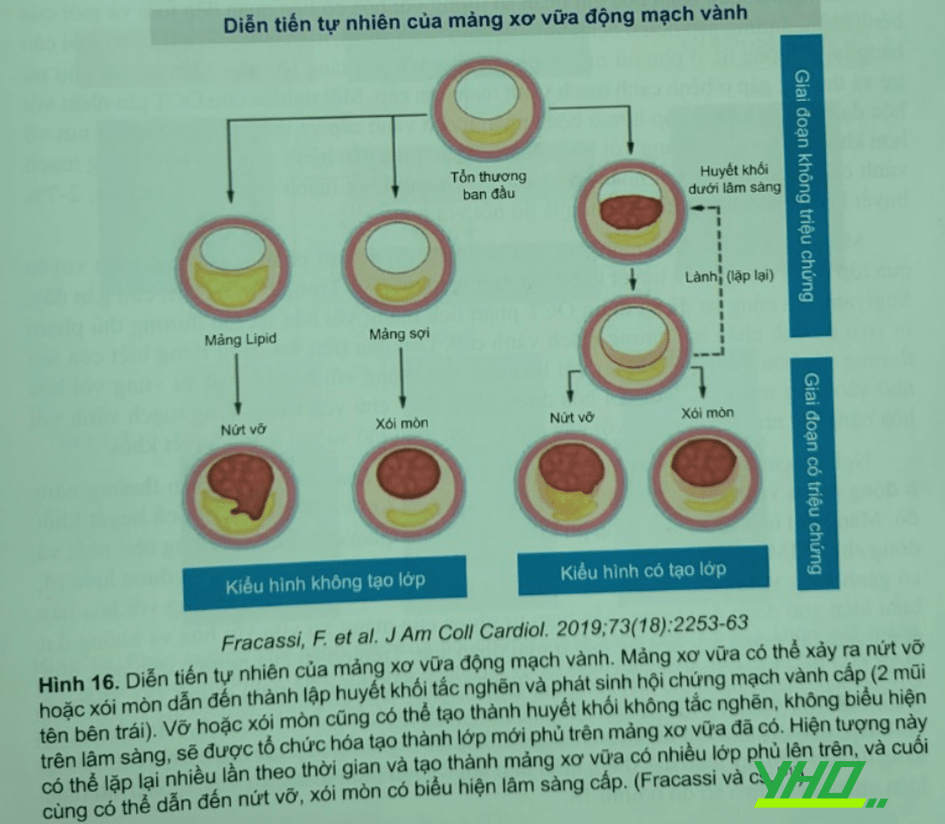
Fracassi và cộng sự nghiên cứu 376 bệnh nhân bị hội chứng mạch vành cấp nhận thấy kiểu dạng lớp trong 29% tổn thương thủ phạm trong hội chứng mạch vành cấp, trong đó 2/3 có kiểu nhiều lớp; mảng xơ vữa đã lành thường gặp hơn ở bệnh nhân hội chứng mạch vành cấp có tăng lipid máu, đái tháo đường và tiền sử nhồi máu cơ tim và bệnh nhân có bệnh mạch vành đa nhánh (Hình 16).
Các mảng xơ vữa đã lành thường biểu hiện đa dạng khi chụp mạch vành, đặc trưng vỡ mảng xơ vữa không ổn định, TCFA và xâm nhiễm đại thực bào . Hơn nữa, hẹp lòng nặng thường gặp trong các mảng xơ vữa nhiều lớp hơn mảng xơ vữa không có lớp hay một lớp, khẳng định hiện tượng đứt vỡ mảng xơ vữa im lặng(nứt vỡ hoặc xói mòn) được quá trình sửa chữa theo sau là cơ chế chính của mảng xơ vữa tiến triển. Theo đó, số lượng vị trí mảng xơ vữa lành được thấy có liên quan đến mức độ hẹp lòng ở vị trí vỡ mảng cấp tính. Mảng xơ vữa lành cũng gặp trong các đoạn mạch vành không thủ phạm. Các cơ chế khác nhau có thể xảy ra trên cùng mảng xơ vữa nền. Cân bằng giữa các yếu tố tăng đông và các yếu tố chống đông có thể có vai trò quan trọng trong hội chứng mạch vành cấp
MẢNG VÔI
Vôi hóa được xem là một dấu hiệu của xơ vữa tiến triển và liên quan chặt với kết cục dự hậu xấu. Tuy nhiên vôi hóa cũng được phát hiện ở các giai đoạn xơ vữa sớm hơn. Điểm vôi hóa nhỏ trong hồ lipid là phổ biến được sinh từ các tế bào cơ trơn chết theo chương trình (apoptosis). Các hạt canxi cũng được thấy trong mảng xơ sợi giai đoạn sớm sau quá trình thoái giáng các đại thực bào tự chết. Các nghiên cứu mô học cho thấy hiện tượng vôi hóa xảy ra nhiều hơn ở các mảng vôi xơ hơn các màng lipid hoặc TCFA.
Các hình thái lắng đọng vôi hóa khác nhau quan sát được ở các tổn thương tiến triển: đốm nhỏ (chủ yếu ở mảng vỡ), phân mảnh (những ổ riêng dạng vết rộng > 2 mm) hoặc lan tỏa (đoạn vôi hóa liên tục dài ≥ 5 mm, chủ yếu ở các mảng xơ vữa lành). Vì ánh sáng khuếch tán ngược từ tổ chức vôi hóa thấp nên vôi hóa được ghi nhận trên OCT là những vùng tín hiệu thấp với bờ rõ (Hình 17), đường kính những hạt calcium hydroxypatide nhỏ hơn chiều dải sóng ánh sáng gần hồng ngoại, nên không thể có hiện tượng giao thoa.
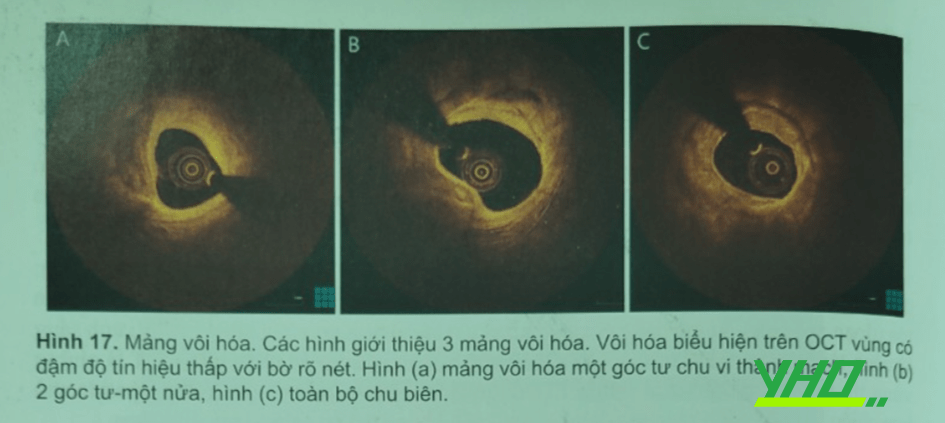
Các nghiên cứu bệnh học ghi nhận số lượng vôi hóa có liên quan đến tuổi và giới của bệnh nhân, thường gặp hơn ở bệnh nhân tuổi 60 (trên 50%), nam giới (chỉ ở tuổi 80 mới cân bằng lại). Tương tự, ở phụ nữ mãn kinh tần suất vôi hóa tăng lên gấp 3 lần so với phụ nữ trẻ và thường gặp ở bệnh cảnh mạch vành mạn hơn cấp. Một nghiên cứu OCT ghi nhận vôi hóa dạng đốm thường gặp hơn ở bệnh nhân mạch vành cấp và thưởng gặp ở mảng nứt vỡ hơn không nứt vỡ. Mảng vôi hóa cũng có liên quan đến bệnh sinh của hội chứng mạch vành cấp, mặc dù nguyên nhân hàng đầu của huyết khối mạch vành là do nứt vỡ, 2 – 7% huyết khối mạch vành gây tử vong là do nốt vôi hóa.
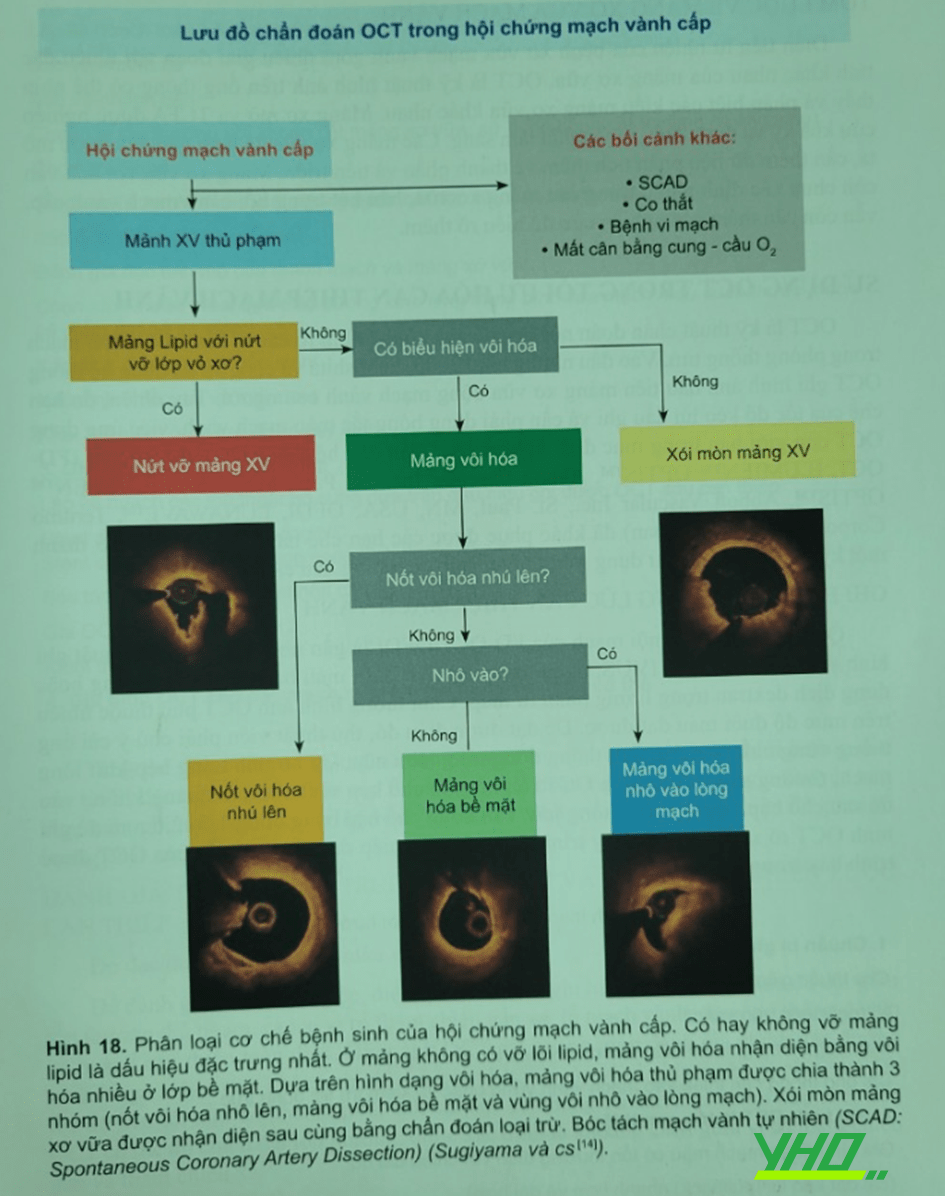
Mô bệnh học nhận diện nốt vôi hóa là mảng vội xơ với phần vôi hóa nhú lên xuyên qua lớp xơ bị đứt gãy và huyết khối cấp mới tạo lập. Trong một nghiên cứu gần đây, Sugiyama và cộng sự đã sự dùng OCT phân tích mảng vôi hóa tại tổn thương thủ phạm in vivo ở bệnh nhân hội chứng mạch vành cấp. Lần đầu tiên, ba dạng riêng biệt của tổn thương vôi hóa được mô tả: nốt vôi hóa nhú lên, mảng vôi hóa bề mặt và vùng vôi hóa nhô vào lòng mạch…. Nối vôi hóa được nhận thấy chủ yếu trong động mạch vành vôi hóa nặng; sự nhú lên của nốt vôi gây đứt vỡ lớp biểu mô và tạo thành huyết khối.
Nghiên cứu OCT của Sugiyama ghi nhận nốt vôi hóa vôi hóa nhú lên thường nằm ở động mạch vành phải, gặp khi gánh nặng vôi hóa lớn và đặc trưng khi có huyết khối đỏ. Mảng vôi hóa bề mặt là dạng phổ biến nhất, liên quan đến diện tích lòng nhỏ nhất có dòng chảy TIMI giảm. Vùng vôi hóa nhỏ vào lòng mạch là ít gặp nhất và ít được hiểu rõ, có gánh nặng vôi hóa ít nhất trong 3 dạng. Các tác giả ước đoán kiểu màng vôi hóa này biểu hiện giai đoạn đầu trong diễn biển tự nhiên của mảng xơ vữa vôi hóa và không đạt đến thành lập mảng vôi hóa bề mặt ở giai đoạn sau. Trên cơ sở của nghiên cứu này, một phân loại mới bệnh sinh của hội chứng mạch vành cấp được đề nghị (Hình 18). Biến cố thường gặp nhất là liên quan đến vỡ mảng xơ vữa lipid, hầu hết là TCFA. Khi không có vỡ mảng lipid và có hiện diện của mảng vôi hóa bề mặt, cần tiếp tục nhận diện một trong dạng đề cập trên tùy theo đặc điểm hình thái học và xói mòn mảng xơ vữa. Quá trình thực hiện chẩn đoán theo sơ đồ ở hình 18.
TÓM LƯỢC VỀ MẢNG XƠ VỮA MẠCH VÀNH
Diễn tiến tự nhiên của bệnh xơ vữa mạch vành gồm nhiều giai đoạn với nhiều đặc tính khác nhau của mảng xơ vữa. OCT là kỹ thuật hình ảnh trên ống thông có thể nhìn thấy và phân biệt các kiểu mảng xơ vữa khác nhau. Mảng xơ mỡ và TCFA được nghiên cứu khá kỹ và được hiểu rõ ý nghĩa lâm sàng. Các mảng xơ vữa đã lành gần đây được mô tả, cần thêm dữ liệu phân tích thêm về thành phần và tiến triển. Mảng xơ vữa vôi hóa vẫn còn chưa xác định nhiều trong các mảng xơ vữa, hầu hết trong bối cảnh mạch vành cấp vẫn còn cần thêm các nghiên cứu để hiểu rõ thêm.
SỬ DỤNG OCT TRONG TỐI ƯU HÓA CAN THIỆP MẠCH VÀNH
OCT là kỹ thuật chẩn đoán nội mạch vành có thể nhìn rõ các vi cấu trúc thành mạch trong phòng thông tim. Vào đầu những năm 2000. Yabushita và cộng sự đã dùng hệ thống OCT ghi hình ảnh đầu tiên mảng xơ vữa động mạch vành con người. Tuy nhiên, do hạn chế của tốc độ kéo lùi đầu ghi và cần phải dùng bóng tắc máu mạch vành, việc ứng dụng OCT còn giới hạn trong mục đích nghiên cứu. Gần đây hệ thống OCT thế hệ mới (FD- OCT, ILUMIENT OPTISTM, Abbott Vascular Inc., St. Paul, MN, USA ILUMIEN™M OPTIST, Abbott Vascular Inc., St. Paul, MN, USA; OFDI, LUNAWAVETM, Terumo Corporation, Tokyo, Japan) đã khắc phục được các hạn chế này. Từ đó, OCT trở thành một kỹ thuật hình ảnh sử dụng trong thực hành để hướng dẫn can thiệp vành.
GHI HÌNH OCT TRONG LÚC CAN THIỆP MẠCH VÀNH
Quá trình ghi hình nội mạch của FD-OCT/OFDI là gần như giống với kỹ thuật ghi hình siêu âm nội mạch IVUS, ngoại trừ việc phải đuổi máu bằng chất cản quang hoặc dung dịch dextran trọng lượng phân tử thấp. Chất lượng hình ảnh OCT phụ thuộc nhiều trên mức độ đuổi máu đạt được. Để đạt được điều đó, thủ thuật viên phải chú ý của ống thông vững chắc với đầu ống thông đồng trục. Hơn nữa, khi có tình trạng hẹp khít lòng mạch, thường sẽ khó ghi hình OCT rõ phía sau chỗ hẹp vị thuốc cản quang không vào đủ sau chỗ hẹp. Trong tình huống này, cần nong chỗ hẹp bằng bóng 1,5- 2,0 mm để ghi hình OCT rõ sau chỗ hẹp. Quy trình thao tác can thiệp dưới hướng dẫn của OCT được trình bày trong Bảng 1.


ĐÁNH GIÁ TỔN THƯƠNG TRƯỚC CAN THIỆP VÀ PHÂN TẦNG CHIẾN LƯỢC CAN THIỆP
Đo đạc đường kính mạch máu và lòng mạch
Để đánh giá trước can thiệp, điều quan trọng là ghi hình đoạn mạch máu đủ dài gồm tổn thương thủ phạm, cả hai vị trí tham chiếu gần xa, lỗ mạch vành, đầu ống thông để lập kế hoạch can thiệp toàn diện. Hình ảnh OCT cắt ngang giúp đánh giá chính xác đường kính lòng và diện tích không chỉ tại chỗ hẹp nhất mà còn vị trí phía trước và phía sau. Do tốc độ kéo lùi đầu dò nhanh, hình ảnh cắt dọc sẽ không có xảo ảnh do co bóp tim, làm OCT có thể đo chiều dài tổn thương, được xác định là khoảng cách giữa vị trí tham chiếu gần và tham chiếu xa
Chọn stent và đặt stent
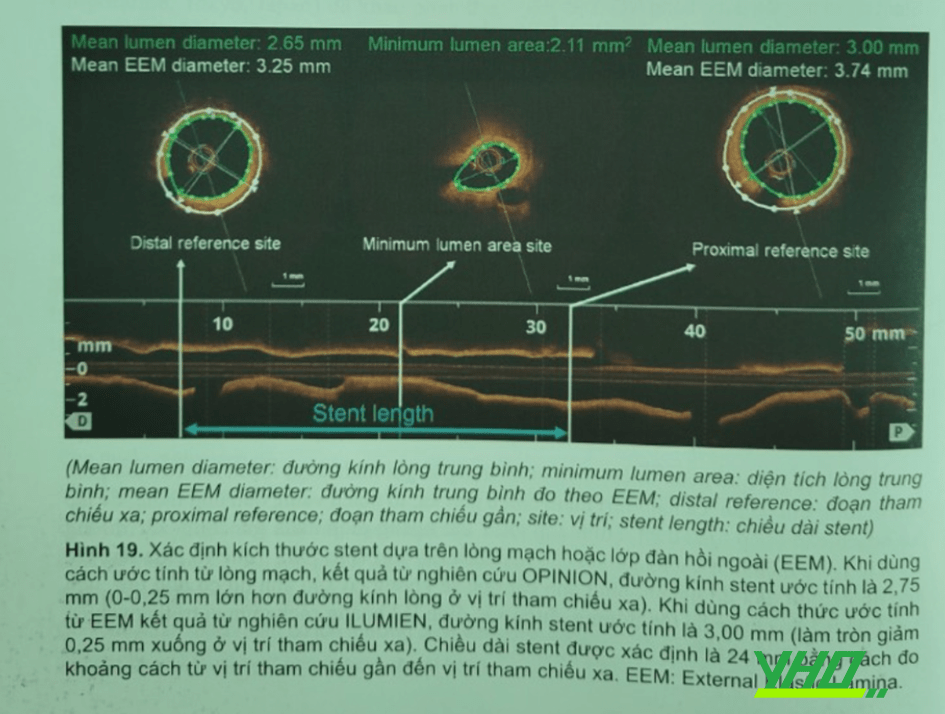
OCT giúp chúng ta đo đạc chính xác chiều dài tổn thương và đường kính lòng mạch, cung cấp các thông tin hữu ích để chọn lựa kích thước stent tối ưu. Stent không bung nở tốt là yếu tố tiên đoán nguy cơ huyết khối trong stent sớm và tái hẹp sau đặt stent. Vì vậy chọn lựa kích thước stent thích hợp và bung stent đủ là quan trong. Mặc dù vẫn còn tranh cãi, đo đạc dựa trên lòng mạch hay dựa trên màng chun giãn ngoài (EEM: External Elastic Membrance) được dùng để chọn lựa kích thước stent. Khi dùng cách thức ước tính qua lòng mạch máu để chọn đường kính stent, sử dụng đường kính lòng mạch trung bình với làm tròn tăng lên 0,25 mm theo nghiên cứu OPINION. Khi dùng cách thức tính toán dựa trên EEM, thường sử dụng đường kính tham khảo nhỏ hơn (thường là vị trí tham khảo xa) để chọn đường kính stent với làm tròn giảm xuống 0.25 mm theo nghiên cứu ILUMIEN- III (Hinh 19).
Trong OCT trước can thiệp, cần đặc biệt chú ý đến tình trạng giảm đường kính tham chiếu xa do giảm áp lực trong mạch vành xa, đặc biệt là trong những tổn thương hẹp khít. Trong trường hợp như vậy, thay đổi thực trong đường kính lòng được ghi nhận là 0,12 mm, khi so sánh với 1/2 biến thể kích thước các stent mạch vành thương mại sẵn có.
Đặc điểm mô giúp phân tầng can thiệp
Thực hiện OCT trước can thiệp giúp bác sĩ can thiệp dễ dàng nhận diện phân bố và đặc tính mảng xơ vữa trong đoạn mạch tổn thương. Phân tích đặc tính mô mảng xơ vữa trên OCT kết hợp với hình ảnh chụp mạch, thủ thuật viên có thể điều chỉnh chiến lược can thiệp, như tác động thay đổi mảng xơ vữa, chọn lựa dụng cụ, bụng đặt stent, và các thủ thuật thêm khác sau đặt stent. Chẳng hạn như tổn thương chứa nhiều lipid hoặc có huyết khối ở chỗ hẹp (diện tích lòng tối thiểu-MLA: Minimum Lumen Area) sẽ là yếu tố tiên đoán hiện tượng không-dòng chảy và nhồi máu cơ tim quanh thủ thuật. Trong trường hợp vôi hóa nặng ở vị trí hẹp nhất, phải tính đến sử dụng thêm dụng cụ hỗ trợ như khoản cắt mảng xơ vữa, bóng cắt.
Đặc tính mô ở vùng đặt bờ stent có thể ảnh hưởng đến chọn lựa chiều dài stent. Vị trí đặt bờ stent tốt nhất ở đoạn tham chiếu bình thường hay là ít tổn thương. Phải tránh vùng có màng lipid hay vôi hóa do có thể phát sinh bóc tách hoặc tái hẹp bờ.
VAI TRÒ OCT TRONG MỘT SỐ TÌNH HUỐNG ĐẶC BIỆT
Tổn thương chỗ chia đôi
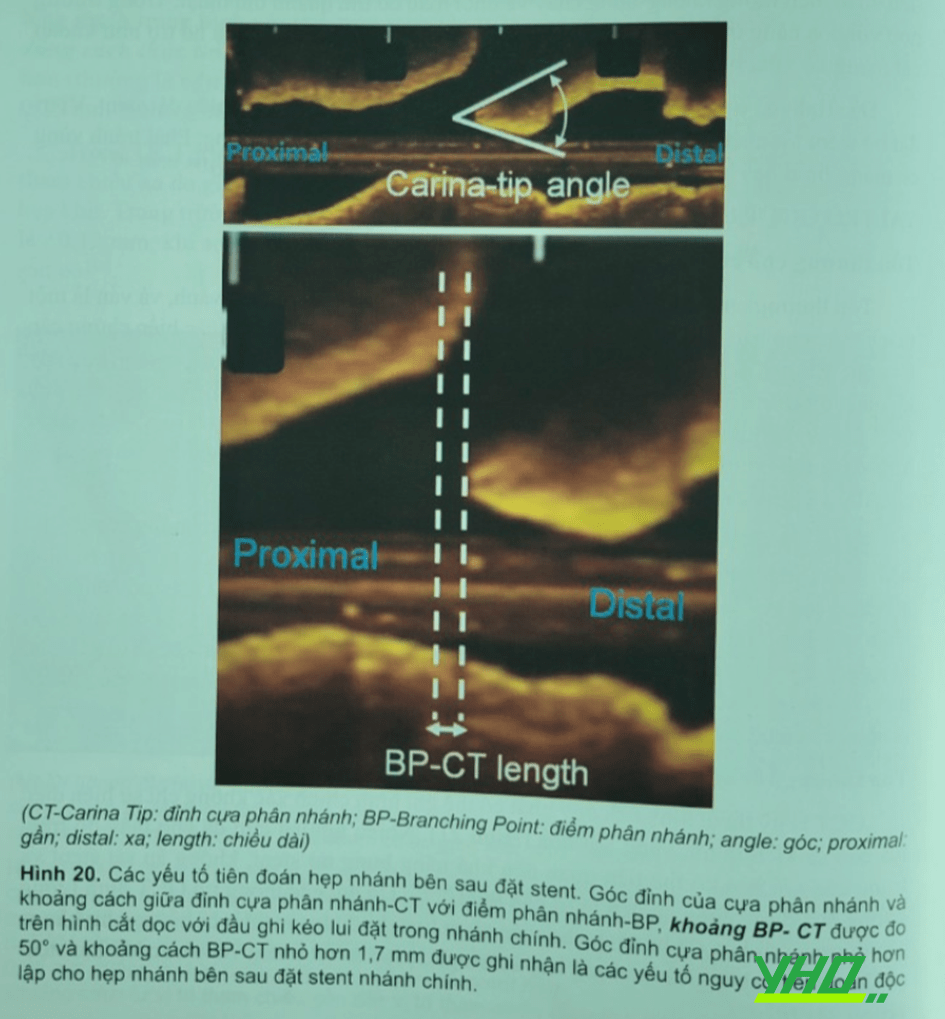
Tổn thương chỗ chia đôi gặp trong khoảng 20% các ca can thiệp vành, và vẫn là một thách thức cho bác sĩ can thiệp vì thủ thuật can thiệp phức tạp và tỷ lệ các biến chứng cấp khá cao. Chụp mạch vành đánh giá tổn thương có những hạn chế và trong trường hợp này kỹ thuật hình ảnh nội mạch vành rất hữu ích cho can thiệp chỗ chia đôi. Đặc biệt hình ảnh OCT cắt dọc có một vai trò quan trọng trong can thiệp chỗ chia đôi nhờ xác định được hình dạng tổn thương tại chỗ bao gồm phân bố mảng xơ vữa, hình dạng lỗ nhánh bên, góc chia đôi và hình dáng của phần gốc,
Đánh giá OCT trước can thiệp chỗ chia đôi có thể tiên đoán biến chứng của nhánh bên sau khi đặt stent nhanh chính. Góc cựa chỗ chia đôi có thể được đo lường trên hình ảnh trục dọc kéo lùi trong nhánh chính. Một nghiên cứu trước đây cho thấy góc đỉnh cựa phân góc hẹp nhỏ hơn 50o và chiều dài đỉnh cựa phân góc ngắn hơn 1,7 mm là yếu tố tiên đoán độc lập cho hẹp nhánh bên sau khi đặt stent nhánh chính (Hình 20). Hơn nữa, phân bố mảng xơ vữa ở vị trí đối diện nhánh bên được biết như là yếu tố nguy cơ biến chứng nhánh bên do cơ chế dịch chuyển cựa phân góc.
Tổn thương vôi hóa
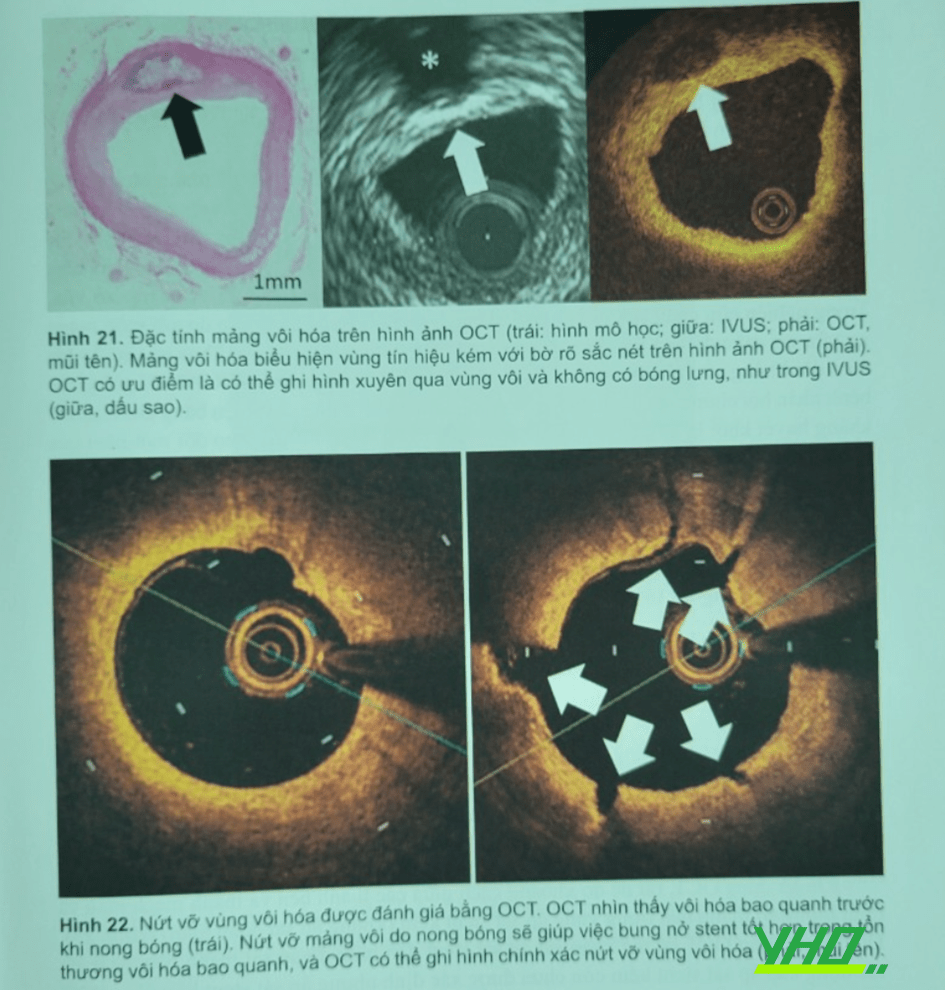
OCT là kỹ thuật hình ảnh duy nhất có thể ghi hình chính xác không chỉ sự hiện diện mà còn cả kích thước vùng vôi hóa (Hình 21). Nhiều nghiên cứu đã cho thấy độ trầm trọng của vôi hóa có thể liên quan đến khả năng bung nở stent, không áp sát stent và không đưa được dụng cụ đến vị trí cần thiết. Do đó, các thông tin OCT định lượng tổn thương vôi hóa rất hữu ích cho việc chọn lựa chỉ định các thiết bị hỗ trợ như khoản cắt Rotablator, bóng cắt (cutting hay scoring) để tạo ra vỡ mảng vôi trước khi đặt stent (Hình 22)
Kubo và cộng sự đã báo chiều dày trung bình của tổn thương vôi đo được ở vị trí nứt vỡ sau nong bóng là 450 µm (interquartile range: 300-660 µm), và vết nứt vỡ tăng thêm khi bung nở stent lớn hơn so với tổn thương không nứt vỡ vôi. Theo đó nếu phần mỏng nhất của tổn thương vôi hóa bao quanh mạch là 450 µm, thiết bị cắt vôi như rotablator hay bóng cắt có thể cần trước khi dùng bóng nong. Không được đặt stent ở tổn thương vôi hóa bao quanh mà chưa nứt vỡ. Trái lại, trong trường hợp tổn thương vôi hóa bao quanh có vùng vôi mỏng nhất ít hơn 450 µm, có thể dùng bóng nong tạo nứt vỡ vôi mà không cần dụng cụ cắt gọt vôi.
Hội chứng mạch vành cấp
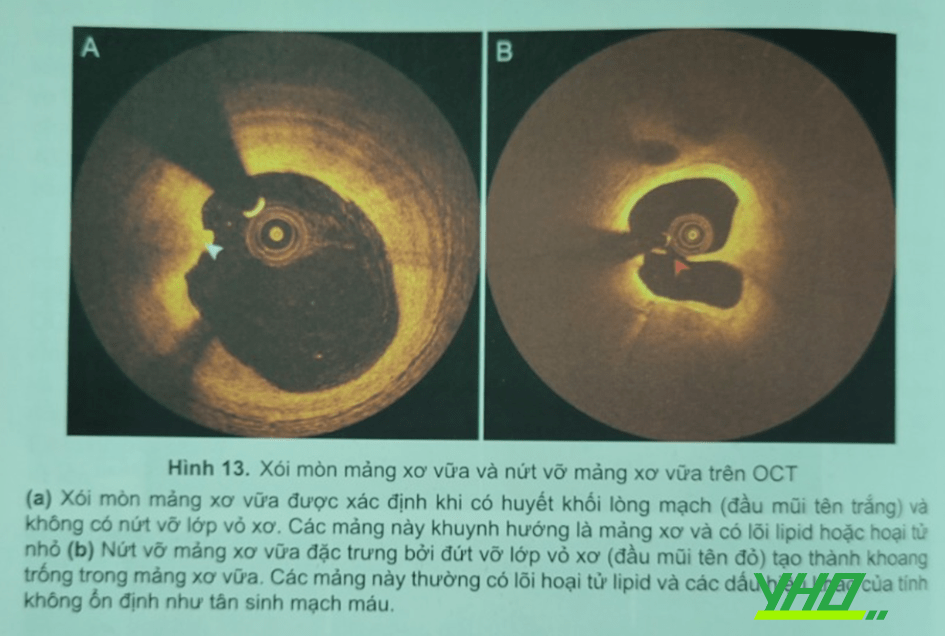
Ở bệnh nhân hội chứng mạch vành cấp, OCT là hữu ích để nhận biết các hình dạng tổn thương thủ phạm đặc trưng. Thường không khuyến cáo dùng dụng cụ bảo vệ thuyên tắc đoạn xa trong can thiệp nhồi máu cơ tim ST chênh lên với mạch vành tự nhiên. Tuy nhiên, có thể lựa chọn dụng cụ này trong trường hợp bệnh nhân có nguy cơ cao bị hiện tượng không tái dòng hay chậm dòng hoặc nhồi máu cơ tim trong thủ thuật. Thực ra, khi tổn thương thủ phạm có mảng vữa xơ vỏ mỏng với vòng cung lipid lớn là một yếu tố tiên đoán cho xảy ra hiện tượng không tái dòng chảy trong can thiệp cấp cứu. Khi có mảng vữa xơ vỏ mỏng hoặc sự vôi hóa dạng nối hay huyết khối trong stent làm tăng nguy cơ nhồi máu cơ tim trong thủ thuật chương trình.
Hơn nữa, OCT tốt hơn IVUS trong nhận diện các tổn thương thủ phạm như vỡ hay xói mỏn mảng xơ vữa và huyết khối tồn dư trong hội chứng mạch vành cấp. Vỡ màng xơ vữa đã được ghi nhận là cơ chế thường gặp nhất, nhưng các nghiên cứu OCT gần đây cho thấy xói mòn mang xơ vữa gặp trong 1/3 trường hợp BN hội chứng mạch vành cấp Bệnh nhân với xói mòn mảng xơ vữa điều trị khác với bệnh nhân bị vỡ mảng xơ vữa. Trong nghiên cứu của Prati và cộng sự, bệnh nhân hội chứng vành cấp do xói mòn mảng xơ vữa với mức độ hẹp tồn dư nhỏ hơn 50% có thể được điều trị nội khoa và sau 2 năm theo dõi không cần phải tái tưới máu gì thêm. Nghiên cứu hồi cứu EROSION gợi ý các bệnh nhân hội chứng mạch vành cấp có nặng vữa xơ vỏ mỏng phát hiện bằng OCT, thuốc kháng huyết khối là một chọn lựa điều trị quan trọng. Các dữ liệu theo dõi một năm của thử nghiệm EROSION đã báo cáo phần lớn (92.5%) bệnh nhân với cơ chế xói mòn có thể được điều trị bằng thuốc kháng huyết khối mà không cần đặt stent vẫn không bị các biển cố tim mạch chính.
TỐI ƯU STENT SAU KHAI ĐẶT
Stent không bung nở tốt
Sự bung nở stent được đánh giá hoặc là bằng số đo diện tích tuyệt đối stent tối thiểu (MSA: Minimum Stent Area) hoặc bằng sự bung nở tương đối so với diện tích tham khảo định trước. Trong nghiên cứu DOCTORS, giá trị ngưỡng cắt của bung nở stent tốt (tiên đoán FFR>0,90) là >79,4%. Giá trị >80 của MSA (so với cả hai diện tích lòng tham chiếu) có vẻ là giá trị ngưỡng cắt hợp lý cho bung nở stent tối ưu . Sự bung nở stent kém là một yếu tố tiên đoàn mạnh cho huyết khối stent sớm và tái hẹp sau đặt stent thuốc theo kết quả của nhiều nghiên cứu IVUS cũng như OCT.
Stent không áp sát
Khi sử dụng OCT, rất dễ đo khoảng cách giữa các thanh bên và thành mạch máu và định lượng số thanh bên trong vùng áp sát stent kém (không áp sát hoàn toàn) (Hình 22), Do đó, sử dụng OCT có thể khảo sát áp sát stent đến mức độ áp sát thanh bên. Mặc dù tác động của áp sát stent kém còn chưa được xác định nhưng áp sát stent kém làm chậm quá trình phủ lớp màng trong mạch tân sinh trên các thanh bên, và do đó có thể kết hợp với huyết khối stent. Nong thêm sau đặt stent được khuyên khi khoảng cách giữa các thanh bên và thành mạch máu hơn 300 µm. Mặt khác, khi không áp sát stent nhẹ với khoảng hở nhỏ (< 250 µm) có thể không cần điều trị vì những khoảng không áp sát nhỏ dường như sẽ biến mất khi theo dõi.
Các biến chứng stent nhẹ khác
Bóc tách bờ stent và sa mô thường xảy ra sau đặt stent. OCT nhạy hơn IVUS để phát hiện các biểu hiện này sau đặt stent.

Mô sa vào lòng mạch bao gồm các thành phần của mảng xơ vữa hoặc huyết khối trong hội chứng vành cấp. Thể tích mô sa vào lòng mạch trên OCT dường như có liên quan đến hình dạng mảng xơ vữa nền và yếu tố tiên đoán tổn thương cơ tim trong thủ thuật. Trong một nghiên cứu sổ bộ lớn gồm 780 bệnh nhân (50% trong bệnh cảnh hội chứng mạch vành cấp), mô sa không đều sau đặt stent được xem là một yếu tố tiên đoán OCT độc lập cho kết cục lâm sáng thời điểm một năm, chủ yếu là do phải tái thông mạch tổn thương đích. Về bóc tách bờ stent, nghiên cứu cho thấy chiều dày mảnh bóc tách > 310 µm có tác động xấu khi theo dõi lâm sàng dài hạn. Trong nghiên cứu CLI-OPCI II, trên OCT khi có bóc tách > 200 µm ở bờ stent xa (nhưng không bờ gần) sẽ biểu hiện như là một yếu tố tiên đoán độc lập các biến cố tim mạch chính. Tuy nhiên, tác động trên tiên lượng của bóc tách bờ stent nhỏ hoặc sa mô nhẹ có thể không ý nghĩa tiên lượng xấu.
PHẦN MỀM OCT MỚI GIÚP CAN THIỆP MẠCH VÀNH THUẬN LỢI HƠN
HỆ THỐNG OCT VỚI CHỤP MẠCH GHI CÙNG LÚC
Kỹ thuật ghi đồng bộ từng điểm thời gian giữa chụp mạch và OCT đã được phát triển. Hệ thống cung cấp các thông tin hữu ích cho bác sĩ can thiệp khi khai đặt stent.
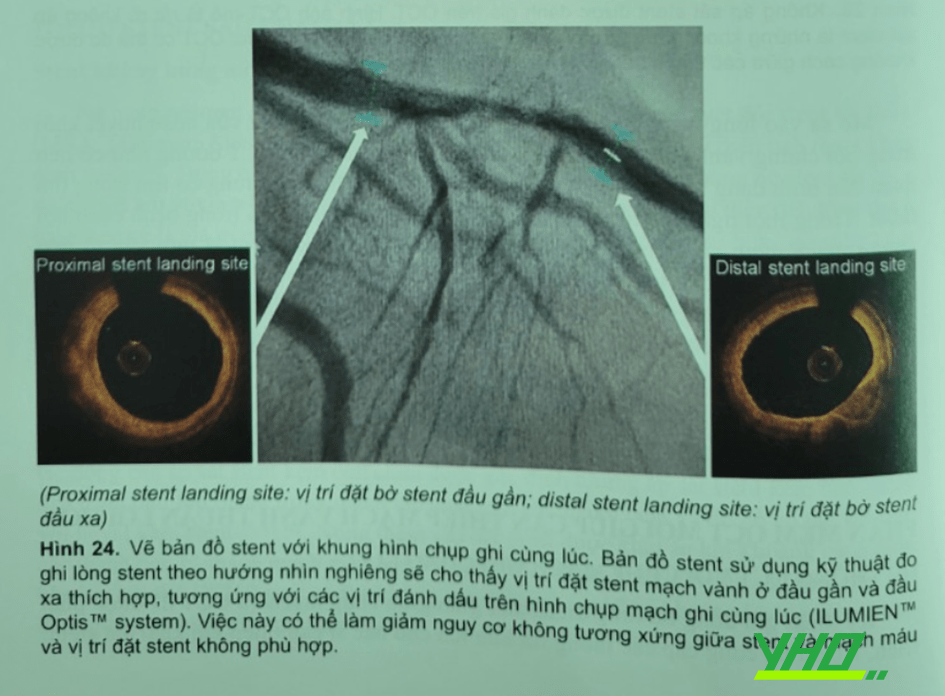
Phần mềm này dùng kỹ thuật đo đạc theo hình nhìn nghiêng lòng mạch của đoạn mạch chứa vị trí đặt stent phần gần và xa thích hợp theo các vị trí đánh dấu trên khung hình chụp mạch ghi cùng lúc (ILUMIENT- Optist system) (Hình 24). Kỹ thuật giúp làm giảm nguy cơ không cân xứng giữa stent với mạch máu và vị trí đặt stent không thích hợp.
ĐÁNH GIÁ TỰ ĐỘNG ÁP SÁT VÀ BỤNG NỞ STENT
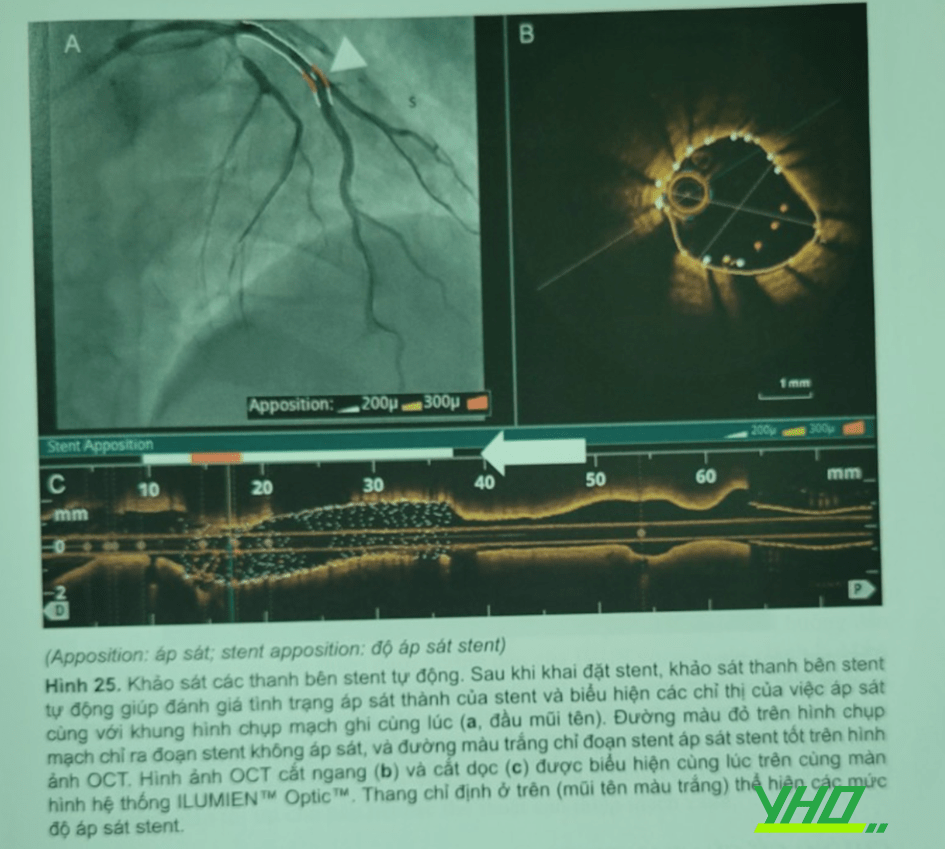
Sau khi đặt stent, phần mềm khảo sát thanh bên stent tự động có thể giúp đánh giá sự áp sát stent và biểu hiện các thang chỉ thị áp sát stent cùng với khung hình chụp mạch ghi cùng lúc (Hình 25, đầu mũi tên). Đường màu đỏ trong hình chụp mạch ghi cùng lúc chỉ stent chưa áp sát. Đường màu trắng trong hình ảnh OCT chỉ stent đã áp sát tốt. Hơn nữa OCT có thể đánh giá stent chưa bung nở tốt, là yếu tố đã được xác định tiên đoán cho thất bại stent (huyết khối stent, tái hẹp trong stent). Tình trạng bung nở stent được biểu hiện trên mặt nhìn nghiêng lòng mạch và các khung hình chụp mạch ghi cùng lúc. Đường màu đỏ chỉ vùng stent chưa bung nở tốt và đường màu trắng chỉ vùng stent đã bung nở tốt. Kỹ thuật này dù chưa được xác định giá trị, vẫn giúp cho bác sĩ tim mạch can thiệp đánh giá được stent có áp sát thành mạch vành hoặc bung nở tốt hay không và giúp quyết định có cần nong stent bung nở thêm nữa hay không.
CT DỰNG HÌNH 3D
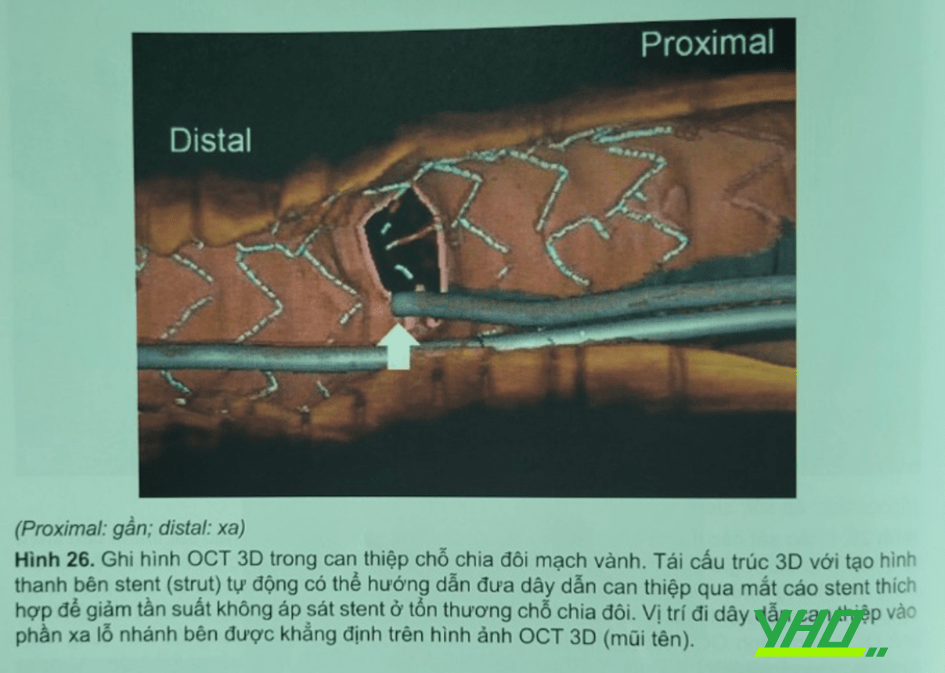
Tái dựng hình OCT 3 chiều (OCT 3D) đầu tiên được mô tả năm 2008, và kỹ thuật này nhanh chóng được cho thấy lợi ích lâm sàng trong can thiệp chỗ chia đội . Chiến lược đặt một stent bắt qua nhánh bên hay còn gọi là đặt một stent chờ (Provisional Stent) hiện nay thường được khuyến cáo cho can thiệp tổn thương chỗ chia đôi. Khi sử dụng kỹ thuật OCT 3D, bác sĩ can thiệp có thể nhận dạng dễ dàng các liên quan trọng không gian 3 chiều của các cấu trúc thanh bên stent bị kẹp, giúp đi lại wire qua stent vào nhanh bên và lỗ nhánh bên. Dựa trên hình ảnh OCT 3D việc đi lại dây dẫn can thiệp qua mắt cáo stent thích hợp (đi qua mắt cáo phần xa) được khuyến cáo để giảm bớt tỷ lệ không áp sát stent ở tổn thương chỗ chia đôi (Hình 26). Sử dụng hình ảnh OCT 3D với phần mềm tự động phát hiện thanh bên stent, lỗ nhánh bên và định vị các mối nối của stent sẽ giúp can thiệp kỹ thuật một stent chờ dễ dàng hơn. Mới gần đây, Okamura và cộng sự báo cáo stent không áp sát có thể ảnh hưởng không chỉ bởi vị trí đi wire lại mà còn do hiện diện mối nối stent trong lỗ nhánh bên và do góc giữa nhánh chính phần xa và nhánh bên
CHỨNG CỨ CỦA CAN THIỆP MẠCH VÀNH DƯỚI HƯỚNG DẪN OCT
Chụp mạch vành định lượng (QCA: Quantitative Coronary Angiography) và siêu âm nội mạch (IVUS: IntraVascular Ultrasound) là những phương pháp chuẩn đã có trong đo lường định lượng các thông số đo diện tích động mạch vành trong can thiệp. Hệ thống OCT ra đời sau nhưng có vẻ ưu việt hơn các phương pháp trước. Nghiên cứu OPUS-CLASS được thiết kế để khảo sát độ tin cậy của OCT trong đo đạc mạch vành so với QCA và IVUS, cho thấy OCT đo đạc định lượng kích thước mạch vành chính xác hơn và có tính lập lại hơn trong thực hành lâm sàng. Trong nghiên cứu này so sánh với các giá trị thực trên mô hình mô phỏng mạch máu đã cho thấy các số liệu đo đạc của IVUS cao hơn và QCA thấp hơn giá trị thực, trong khi đó OCT ghi được gần như giống với giá trị thực.
Tính ưu việt của can thiệp dưới hướng dẫn của IVUS so với can thiệp dựa trên chụp mạch trên các biến cố tim mạch chính và tái thông mạch tổn thương đích do thiếu máu cơ tim sau đặt stent thuốc đã được xác định trong nhiều thử nghiệm làm sàng và phân tích gộp. Trái lại, các dữ liệu so sánh giữa can thiệp dưới hướng dẫn OCT và can thiệp chỉ dùng chụp mạch còn tương đối ít. Một nghiên cứu sổ bộ hồi cứu cho thấy can thiệp dưới hướng dẫn OCT làm giảm tỷ lệ tử vong và biến cố tìm mạch chính. Một nghiên cứu mô tả khác cũng ghi nhận can thiệp dưới hướng dẫn của OCT đạt được kích thước lòng tối thiểu trong stent lớn hơn (MLD: Minimum Lumen Diameter).
Tuy nhiên, đến nay chưa có thử nghiệm lâm sàng nào so sánh kết cục lâm sàng can thiệp dưới hướng dẫn OCT với can thiệp chỉ dùng chụp mạch. Hiện nay nghiên cứu đang thực hiện so sánh can thiệp dưới hướng dẫn OCT và can thiệp chỉ dựa trên chụp mạch là ILUMIEN-IV (NCT0350777) và OCTOBER (NCT03171311) Các nghiên cứu này hiện đã thu nhận tương ứng theo thứ tự đến 3.656 và 1.200 bệnh nhân. Về việc so sánh giữa can thiệp dưới hướng dẫn OCT và can thiệp dưới hướng dẫn IVUS có hai thử nghiệm lâm sàng đã được báo cáo. Thử nghiệm OPINION gồm 829 bệnh nhân cho thấy can thiệp dưới hướng dẫn của OCT không kém hơn can thiệp dưới hướng dẫn của IVUS với các tiêu chỉ lâm sàng thất bại mạch máu đích trong 12 tháng (5,2% vs 4,9%, P không kém hơn < 0,05). Nghiên cứu ILUMIEN-III gồm 450 bệnh nhân nhằm trả lời cho câu hỏi can thiệp dưới hướng dẫn OCT với quy trình tối ưu chuyên biệt có tương đương với can thiệp dưới hướng dẫn IVUS hay không. Kết quả can thiệp dưới hướng dẫn OCT tương đương với can thiệp dưới hướng dẫn của IVUS với tiêu chí chính là MSA (Minimum Stent Area: diện tích trong stent tối thiểu). Cả hai nghiên cứu OPINION và ILUMIEN-III đã cho thấy OCT không kém hơn IVUS với tiêu chí thất bại mạch đích (TVF: Target Vessel Failure) và MSA tương ứng. Do đó, chúng ta đã có được đồng thuận từ các chuyên gia rằng IVUS và OCT là tương đương (và tốt hơn chụp mạch) trong hướng dẫn tối ưu cho hầu hết các thủ thuật can thiệp mạch vành.
SỰ PHÁT TRIỂN KỸ THUẬT OCT TẠI VIỆT NAM
Tại Việt Nam, vào tháng 06 năm 2013, Bệnh viện Thống nhất Thành phố Hồ Chí Minh là nơi đầu tiên triển khai kỹ thuật OCT (hệ thống Ilumion) trong chẩn đoán và điều trị bệnh mạch vành. Gần đây đã có thêm một số bệnh viện khác đang bắt đầu triển khai kỹ thuật OCT như Bệnh viện E, Bệnh viện Tâm Anh…
Với độ phân giải cao, OCT đã giúp chẩn đoán đặc điểm tổn thương xơ vữa động mạch vành và tối ưu kết quả can thiệp mạch vành
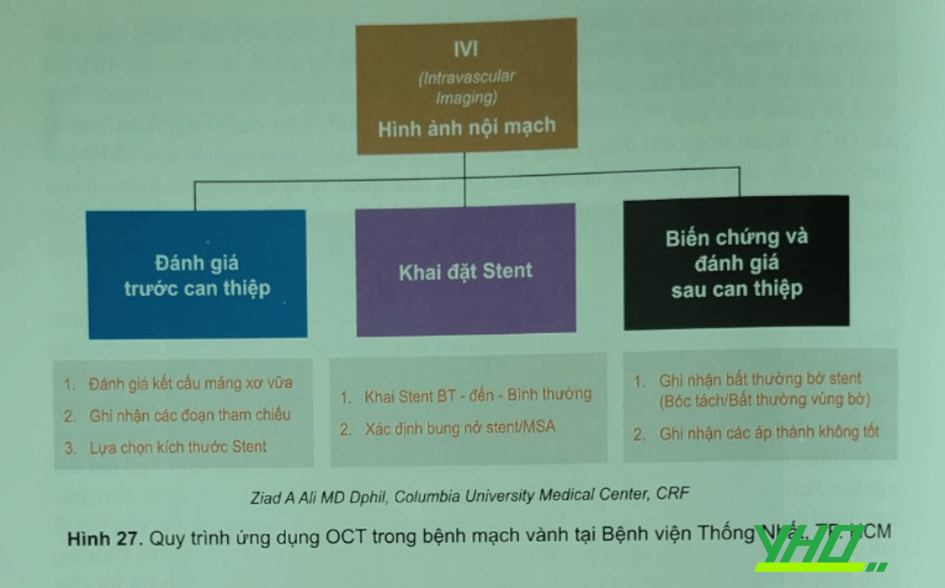
Tại phòng thông tim Bệnh viện Thống Nhất Thành phố Hồ Chí Minh, kỹ thuật hình ảnh OCT được sử dụng thường quy trong can thiệp mạch vành đặc biệt là những trường hợp tổn thương khó, phức tạp hay khó quyết định, giúp tối ưu hóa điều trị can thiệp. Quy trình áp dụng thực hiện theo hướng dẫn của SCAI (Hình 27)
KẾT LUẬN
Ngày nay, phòng thông tim, nhất là ở những trung tâm tim mạch lớn ngày càng có nhiều thách thức khi xử tri can thiệp với số lượng nhiều hơn, tuổi bệnh nhân cao hơn, tổn thương rất phức tạp và trên cơ địa nguy cơ cao. Các khuyến cáo ngày nay đều khuyến khích việc sử dụng các phương tiện hỗ trợ trong can thiệp nhằm giúp tối ưu hóa kết quả can thiệp và kết cục lâm sàng cho bệnh nhân. Các kỹ thuật hình ảnh nội mạch vành là một trong những phương tiện được khuyến khích sử dụng thưởng quy
OCT là kỹ thuật ghi hình ảnh nội mạch vành ra đời sau so với các kỹ thuật khác như IVUS. Tuy nhiên, với ưu điểm hình ảnh rất rõ nét do độ phân giải cao, dễ lý giải và đặc biệt trong một số dạng tổn thương (vôi hóa, tổn thương mạch vành cấp, bóc tách…) và khả năng đánh giá stent đã giúp OCT có vị trí trong trong hướng dẫn và tối ưu can thiệp mạch vành trong thực hành lâm sàng.
Với những tiến bộ trong kỹ thuật như các phần mềm mới giúp dụng hình OCT 3D hoặc dựng hình stent và mạch vành hướng dẫn can thiệp dễ dàng và hiệu quả hơn… và với các dữ liệu nghiên cứu lâm sang ngày càng nhiều, chắc chắn OCT sẽ có một vị trí vùng chắc hơn trong tối ưu can thiệp mạch vành.
TÀI LIỆU THAM KHẢO
1. Huang D, Swanson EA, Lin CP, Schuman JS, Stinson WG, Chang W, Hee MR, Flotte T. Gregory K, Puliafito CA, Fujimoto JG. Optical coherence tomography. Science. 1991:254:1178-81.
2. Brezinski ME, Tearney GJ, Bouma BE, Izatt JA, Hee MR, Swanson EA, Southern JF, Fu- jimoto JG. Optical coherence tomography for optical biopsy. Properties and demonstration of vascular pathology. Circulation. 1996;93:1206-13.
3. Fujimoto J, Swanson E. The development, commercialization, and impact of optical coher- ence tomography. Invest Ophthalmol Vis Sci. 2016;57:OCT1-OCT13.
4. Swanson EA, Fujimoto JG. The ecosystem that powered the trans-lation of OCT from fundamental research to clinical and commer-cial impact. Biomed Opt Express, 1638- 1664;8:2017.
5. Tearney GJ, Brezinski ME, Boppart SA, Bouma BE, Weissman N. Southern JF, Swanson EA, Fujimoto JG. Catheter-based optical imaging of a human coronary artery. Circulation. 1996;94:3013.
6. Jang IK, Tearney G, Bouma B. Visualization of tissue prolapse between coronary stent struts by optical coherence tomogra-phy: comparison with intravascular ultrasound. Circulation. 2001;104:2754.
7. Virmani R, Kolodgie FD. Burke AP, Farb A, Schwartz SM. Lessons from sudden coronary death: a comprehensive morphological clas-sification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol. 2000;20(5):1262-75.
8. Finn AV, Nakano M, Narula J, Kolodgic FD. Virmani R. Concept of vulnerable/unstable plaque. Arterioscler Thromb Vasc Biol. 2010;30(7):1282-92. 9. Fujimoto JG. Optical coherence tomography for ultrahigh resolu- tion in vivo imaging. Nat Biotechnol. 2003;21(11):1361-7.
10. Jang IK, Bouma BE, Kang DH, et al. Visualization of coronary ath- erosclerotic plaques in patients using optical coherence tomogra-phy: comparison with intravascular ultrasound. J Am Coll Cardiol. 2002:39(4):604-9.
11. Prati F, Regar E, Mintz GS, et al. Expert review document on meth- odology, terminology, and clinical applications of optical coherence tomography: physical principles, methodol- ogy of image acquisi- tion, and clinical application for assessment of coronary arteries and atherosclerosis. Eur Heart J. 2010;31(4):401-15.
12. Di Vito L, Yoon JH, Kato K, et al. Comprehensive overview of defi-nitions for optical coher- ence tomography-based plaque and stent analyses. Coron Artery Dis. 2014;25(2):172-85.
13. Otsuka F, Joner M, Prati F, Virmani R, Narula J. Clinical classifica-tion of plaque morphol- ogy in coronary disease. Nat Rev Cardiol. 2014;11(7):379-89. 14. Sugiyama T, Yamamoto E, Fracassi F, et al. Calcified plaques in patients with acute coro-
nary syndromes. JACC Cardiovasc Interv 2019;12(6):531-40.
15. Yahagi K, Kolodgie FD, Otsuka F, et al. Pathophysiology of native coronary, vein graft, and in-stent atherosclerosis. Nat Rev Cardiol. 2016;13(2):79-98.
16. Yabushita H. Bouma BE, Houser SL, et al. Characterization of human atherosclerosis by optical coherence tomography. Circulation. 2002;106(13):1640-5.
17. Otsuka F, Kramer MC, Woudstra P, et al. Natural progression of atherosclerosis from pathologic intimal thickening to late fibroatheroma in human coronary arteries: a patholo- gy study. Atherosclerosis. 2015;241(2):772-82.
18. Stupka N, Kintakas C, White JD, et al. Versican processing by a disintegrin-like and metal- loproteinase domain with thrombospon- din-1 repeats proteinases-5 and -15 facilitates myoblast fusion. J Biol Chem. 2013:288(3):1907-17.
19. Yonetsu T. Kakuta T, Lee T, et al. In vivo critical fibrous cap thick- ness for rup- ture-prone coronary plaques assessed by optical coherence tomography. Eur Heart J. 2011:32(10):1251-9.
20. Lee CW, Hwang I, Park CS, et al. Comparison of ADAMTS-1,-4 and -5 expression in culprit plaques between acute myocardial infarction and stable angina. J Clin Pathol 2011:64(5):399-404.
21. Ruggio A, Pedicino D. Flego D, et al. Correlation between CD4+CD28null T lymphocytes. regulatory T cells and plaque rup- ture: an optical coherence tomography study in acute coronary syn- dromes. Int J Cardiol. 2019,276:289-92.
22. Takarada S, Imanishi T, Kubo T, et al. Effect of statin therapy on coronary fibrous-cap thickness in patients with acute coronary syndrome: assessment by optical coherence to- mography study. Atherosclerosis. 2009;202(2):491-7.
23. Nishiguchi T, Kubo T. Tanimoto T, et al. Effect of early pitavas- tatin therapy on coronary fibrous-cap thickness assessed by optical coherence tomography in patients with acute coronary syndrome; the ESCORT study, JACC Cardiovasc Imaging. 2018;11(6):829-38
24. Romagnoli E, Gatto L, La Manna A, et al. Role of single OCT morphological variable in the CLIMA trial (relationship between coronary plaque morphology of the left anterior descending artery and long terM clinical outcome). J Am Coll Cardiol. 2018;72(13 Sup- pl):B24.
25. Fracassi F. Niccoli G. Vetrugno V, et al. Optical coherence tomography and C-reactive protein in risk stratification of acute coronary syndromes. Int J Cardiol. 2019;286:7-12 26. Davies MJ. The contribution of thrombosis to the clinical expres- sion of coronary athero- sclerosis. Thromb Res. 1996;82(1):1-32.
27. Yamamoto MH. Yamashita K, Matsumura M, et al. Serial 3-vessel optical coherence to- mography and intravascular ultrasound analy- sis of changing morphologies associated with lesion progression in patients with stable angina pectoris. Circ Cardiovasc Imaging 2017;10(9):c006347.
28. Burke AP, Kolodgie FD, Farb A, et al. Healed plaque ruptures and sudden coronary death: evidence that subclinical rupture has a role in plaque progression. Circulation. 2001;103(7):934-40.
29. Mann J, Davies MJ. Mechanisms of progression in native coronary artery disease: role of healed plaque disruption. Heart. 1999;82(3):265-8.
30. Jang IK. Plaque progression: slow linear or rapid stepwise? Circ Cardiovasc Imaging 2017:10(9):e006964.
31. Fracassi F, Crea F, Sugiyama T, et al. Healed culprit plaques in acute coronary syndromes. J Am Coll Cardiol. 2019;73(18):2253-63. 32. Shimokado A, Matsuo Y, Kubo T, et al. In vivo optical coherence tomography imaging and histopathology of healed coronary plaques. Atherosclerosis. 2018;275:35-42.
33. Vergallo R, Porto 1. D’Amario D. et al. Coronary atherosclerotic phenotype and plaque healing in patients with recurrent acute coronary syndromes compared with patients with long-term clinical stability: an in vivo optical coherence tomography study. JAMA Cardiol. 2019: https://doi.org/10.1001/jamacardio.2019.0275.
34. Detrano R, Guerci AD, Carr JJ, et al. Coronary calcium as a predic- tor of coronary events in four racial or ethnic groups. N Engl J Med. 2008;358(13):1336-45.
35. Otsuka F. Sakakura K, Yahagi K, Joner M, Virmani R. Has our understanding of calci- fication in human coronary atherosclerosis progressed? Arterioscler Thromb Vasc Biol. 2014:34(4):724-36.
36. Burke AP, Weber DK. Kolodgie FD, Farb A, Taylor AJ, Virmani R. Pathophysiology of calcium deposition in coronary arteries. Herz. 2001;26(4):239-44.
37. Friedrich GJ, Moes NY, Mühlberger VA, et al. Detection of intral- esional calcium by intra- coronary ultrasound depends on the histo- logic pattern. Am Heart J. 1994;128(3):435-41.
38. Burke AP, Virmani R, Galis Z, Haudenschild CC. Muller JE. 34th Bethesda conference: task force #2–what is the pathologic basis for new atherosclerosis imaging techniques? J Am Coll Cardiol. 2003;41(11):1874-86.
39. Mizukoshi M, Kubo T, Takarada S, et al. Coronary superficial and spotty calcium deposits in culprit coronary lesions of acute coronary syndrome as determined by optical coherence tomography. Am J Cardiol. 2013;112(1):34-40.
40. Ong DS, Lee JS, Soeda T, et al. Coronary calcification and plaque vulnerability: an optical coherence tomographic study. Circ Cardiovasc Imaging. 2016;9(1):e003929. 41. Virmani R, Burke AP, Farb A, Kolodgie FD. Pathology of the vulnerable plaque. J Am Coll Cardiol. 2006;47(8 Suppl):C13-8.
42. Kubo T. Shinke T, Okamura T, Hibi K, Nakazawa G, Morino Y, et al. Optical frequency do- main imaging vs. intravascular ultrasound in percutaneous coronary in tervention (opinion trial): one-year angio- -graphic and clinical results. Eur Heart J. 2017;38:3139-47.
43. Kurokawa M, Uemura S, Watanabe M. Dote Y, Sugawara Y, Goryo Y, et al. Changes in the reference lumen size of target lesions before and after coronary stent implantation: eval- uation with frequency domain optical coherence tomography. Int J Cardiol Heart Vase. 2015:8:122-12.7.
44. Chamie D, Bezerra HG, Attizzani GF, Yamamoto H, Kanaya T, Stefano GT, et al. Incidence, predictors, morphological charac-teristics, and clinical outcomes of stent edge dissections detected by optical coherence tomography. JACC Cardiovasc Interv 2013;6:800-13.
45. Ino Y, Kubo T. Matsuo Y, Yamaguchi T, Shiono Y, Shimamura K, et al. Optical coherence tomography predictors for edge restenosis after everolimus-eluting stent implantation. Circ Cardiovasc Interv 2016:9:e004231.
46. Ueda T, Uemura S, Watanabe M, Dote Y, Goryo Y, Sugawara Y, et al. Thin-cap fibroather- oma and large calcification at the proximal stent edge correlate with a high proportion of uncovered stent struts in the chronic phase. Coron Artery Dis. 2016;27:376-84.
47. Watanabe M. Uemura S, Sugawara Y, Ueda T, Soeda T, Takeda Y, et al. Side branch com-plication after a single-stent crossover tech- nique: prediction with frequency domain opti-cal coherence tomog-raphy. Coron Artery Dis. 2014;25:321-9.
48. Kobayashi Y. Okura H, Kume T, Yamada R. Kobayashi Y, Fukuhara K, et al. Impact of target lesion coronary calcification on stent expansion. Cire J. 2014;78:2209-14. 49. Maejima N, Hibi K, Saka K. Akiyama E, Konishi M. Endo M, et al. Relationship between thickness of calcium on optical coherence tomography and crack formation after balloon dilatation in calcified plaque requiring rotational atherectomy. Cire J. 2016:80:1413-9.
50. Koyama T. Okura H. Kume T. Fukuhara K, Neishi Y, Hayashida A. et al. Calcified plaque ablated by rotational atherectomy visualised by optical coherence tomography. EuroIntervention 2015:11:el.
51. Tanaka A, Imanishi T, Kitabata H, Kubo T, Takarada S, Tanimoto T, et al. Lipid-rich plaque and myocardial perfusion after successful stenting in patients with non-st-segment elevation acute coronary syndrome: an optical coherence tomography study. Eur Heart J. 2009:30:1348-55.
52. Ueda T. Uemura S, Watanabe M, Sugawara Y, Soeda T, Okayama S, et al. Colocaliza- tion of thin-cap fibroatheroma and spotty cal-cification is a powerful predictor of proce- dure-related myocardial injury after elective coronary stent implantation. Coron Artery Dis. 2014;25:384-91.
53. Porto I, Di Vito L, Burzotta F, Niccoli G, Trani C, Leone AM, et al. Predictors of periproce- dural (type IVa) myocardial infarction, as assessed by frequency-domain optical coherence tomography. Circ Cardiovasc Interv 2012:5:89-96, S81-86.
54. Kubo T. Imanishi T, Takarada S, Kuroi A, Ueno S, Yamano T, et al. Assessment of culprit lesion morphology in acute myocar-dial infarction: ability of optical coherence tomogra phy compared with intravascular ultrasound and coronary angioscopy. J Am Coll Cardiol. 2007:50:933-9.
55. Gutierrez-Chico JL, Alegria-Barrero E. Teijeiro-Mestre R, Chan PH, Tsujioka H, de Silva R, et al. Optical coherence tomogra- phy: from research to practice. Eur Heart J Cardio- vasc Imaging. 2012;13:370-84.
56. Meneveau N, Souteyrand G. Motreff P, Caussin C, Amabile N, Ohlmann P, et al. Opti- cal coherence tomography to optimize results of percutaneous coronary intervention in patients with non-st-elevation acute coronary syndrome: results of the multicenter, ran- domized doctors study (does optical coherence tomography optimize results of stenting). Circulation. 2016;134:906-17.
57. Raber L, Mintz GS, Koskinas KC, Johnson TW, Holm NR, Onuma Y, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus docu-ment of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39:3281-300.
58. Sonoda S, Morino Y. Ako J. Terashima M, Hassan AH, Bonneau HN, SIRIUS Investiga- tors, et al. Impact of final stent dimensions on long-term results following sirolimus-clut- ing stent implantation: serial intravascular ultrasound analysis from the sirius trial. J Am Coll Cardiol. 2004;43:1959-63.
59. Soeda T. Uemura S, Park SJ, Jang Y, Lee S, Cho JM. et al. Incidence and clinical signifi- cance of poststent optical coherence tomogra-phy findings: one-year follow-up study from a multicenter registry. Circulation. 2015;132:1020-9.
60. Guo N, Machara A, Mintz GS, He Y, Xu K, Wu X, et al. Incidence, mechanisms, predic- tors, and clinical impact of acute and late stent malapposition after primary intervention in patients with acute myocardial infarction: an intravascular ultrasound substudy of the harmonizing outcomes with revascularization and stents in acute myocardial infarction (horizons-ami) trial. Circulation. 2010;122:1077-84.
61. Romagnoli E, Gatto L, La Manna A, Burzotta F. Taglieri N, Saia F, et al. Role of residual acute stent malapposition in percutaneous cor- onary interventions. Catheter Cardiovasc Interv. 2017:90:566-75.
62. Finn AV, Joner M, Nakazawa G, Kolodgie F, Newell J, John MC, et al. Pathological cor- relates of late drug-eluting stent thrombo- sis: strut coverage as a marker of endothelializa- tion. Circulation. 2007;115:2435-41.
63. Kawamori H, Shite J, Shinke T, Otake H, Matsumoto D, Nakagawa M, et al. Natural con- sequence of post-intervention stent malap- position, thrombus, tissue prolapse, and dis- section assessed by optical coherence tomography at mid-term follow-up. Eur Heart J Cardiovasc Imaging. 2013;14:865-75.
64. Ali ZA, Machara A, Genereux P. Shlofmitz RA, Fabbiocchi F, Nazif TM, et al. Optical coherence tomography compared with intravascular ultrasound and with angiography to guide coronary stent implantation (ILUMIEN III: OPTIMIZE PCI): a randomised con- trolled trial. Lancet. 2016;388:2618-28.
65. Tearney GJ, Waxman S, Shishkov M. Vakoc BJ, Suter MJ, Freilich MI, et al. Three-dimen- ional coronary artery microscopy by intra-coronary optical frequency domain imaging. JACC Cardiovasc Imaging. 2008;1:752-61.
66. Okamura T, Onuma Y, Yamada J, Iqbal J, Tateishi H, Nao T, et al. 3D optical coherence tomography: new insights into the process of optimal rewiring of side branches during bifurcational stenting. EuroIntervention. 2014:10:907-15.
67. Okamura T, Nagoshi R, Fujimura T, Murasato Y. Yamawaki M, Ono S, et al. Impact of guidewire recrossing point into stent jailed side branch for optimal kissing bal- loon dilatation: core lab 3D optical coherence tomography analysis. EuroIntervention. 2018;13:e1785-93.
68. Kubo T. Akasaka T, Shite J, Suzuki T, Uemura S, Yu B, et al. OCT compared with IVUS in a coronary lesion assessment: the OPUS- CLASS study. JACC Cardiovasc Imaging.2013:6:1095-104.
69. 46. Bavishi C, Sardar P, Chatterjee S, Khan AR, Shah A, Ather S, et al. Intravascular ultra- sound-guided vs angiography-guided drug-eluting stent implantation in complex coronary lesions: meta-analysis of randomized trials. Am Heart J. 2017:185:26-34.
70. Elgendy IY, Mahmoud AN, Elgendy AY, Bavry AA. Outcomes with intravascular ul- trasound-guided stent implantation: a meta- analysis of randomized trials in the era of drug-eluting stents. Circ Cardiovasc Interv. 2016;9:c003700. 71 Sheth TN, Kajander OA, Lavi S, Bhindi R. Cantor WJ, Cheema AN, et al. Optical coherencetomography-guided percutaneous cor- onary intervention in st-segment-elevation myocar-dial infarction: a prospective propensity-matched cohort of the thrombectomy ver-sus per-cutaneous coronary intervention alone trial. Circ Cardiovasc Interv 2016:9:e003414.